Proses terpenting selama pembakaran. Dasar fisika-kimia dari proses pembakaran. Klasifikasi proses pembakaran
Perbedaan penafsiran konsep pembakaran disebabkan oleh arah kepentingan keilmuan penulis. Menurut pendapat kami, definisi pembakaran berikut ini paling memenuhi kepentingan praktis pegawai Dinas Pemadam Kebakaran Negara:
Pembakaran adalah kompleks yang mandiri proses fisika-kimia, yang didasarkan pada reaksi oksidasi kimia yang cepat, disertai dengan pelepasan sejumlah besar panas dan cahaya.
Williams, Teori Pembakaran. Transformasi kimia yang kompleks dan cepat yang disertai dengan pelepasan sejumlah besar panas dan biasanya pendaran yang kuat. Dalam kebanyakan kasus, ini didasarkan pada reaksi oksidasi eksotermik dari zat yang mudah terbakar dengan zat pengoksidasi. Teori fisikokimia modern mengklasifikasikan pembakaran sebagai semua proses kimia yang melibatkan transformasi cepat dan percepatannya akibat panas atau difusi, termasuk penguraian bahan peledak dan ozon, kombinasi sejumlah zat dengan klor dan fluor, serta reaksi banyak logam dengan klor dan oksida oksida. natrium dan barium dengan karbon dioksida.
Proses yang dominan pada pembakaran adalah reaksi oksidasi kimia yang menimbulkan berbagai macam reaksi proses fisik: perpindahan panas, perpindahan zat yang bereaksi, radiasi, dll. Proses fisik ini berkembang menurut hukumnya sendiri. Proses kimia oksidasi memiliki potensi besar dalam hal laju terjadinya, namun kecepatan sebenarnya pembakaran pada kebakaran nyata lebih rendah, karena dibatasi oleh kecepatan proses fisik.
Dalam kebanyakan kasus, reaksi pembakaran kimia bersifat kompleks, yaitu. terdiri dari sejumlah besar proses kimia dasar. Selain itu, transformasi kimia selama pembakaran berkaitan erat dengan sejumlah proses fisik, seperti perpindahan panas dan massa, dan dicirikan oleh hukum hidrodinamika dan dinamika gas yang sesuai. Karena sifat pembakaran yang kompleks, kecepatan keseluruhannya praktis tidak berbeda dengan kecepatan pembakaran murni. reaksi kimia reagen sistem; selain itu, dalam kasus proses heterogen, laju pembakaran sering kali sama dengan laju beberapa proses fisik murni yang membatasi.
Reaksi kimia selama pembakaran bersifat multi-tahap, ...
dan yang paling penting, rantai. Tanpa memahami mekanisme proses yang terjadi, mustahil untuk memahami penyebab penyebaran api, perbedaan kecepatannya, nilai suhu pembakaran, dll.
Mekanisme reaksi kimia selama pembakaran
Dalam topik “Kinetika Kimia” kami mencatat bahwa reaksi kimia terjadi melalui kontak langsung komponen yang bereaksi (molekul, atom, radikal), tetapi hanya jika energinya melebihi batas energi tertentu, yang disebut energi aktivasi E a. Mari kita gambarkan secara grafis perubahan energi komponen yang bereaksi (bahan bakar dan oksidator) dan produk reaksi selama pembakaran (Gbr. 1.1.)
Sifat pembakaran yang paling umum adalah kemungkinan, dalam kondisi tertentu, eksitasi diri progresif dari penyalaan transformasi kimia yang terkait dengan akumulasi panas atau produk aktif dalam sistem reaksi. reaksi berantai. Ciri khas pembakaran adalah kemampuannya menyebar di ruang angkasa melalui perpindahan panas atau difusi partikel aktif; dalam kasus pertama, mekanisme perambatan api bersifat termal, dan yang kedua, difusi. Adanya kondisi kritis - yaitu, area nilai parameter tertentu yang merupakan karakteristik sistem pembakaran tertentu, di luarnya pembakaran berlangsung terus-menerus dan di dalamnya terdapat akumulator otomatis, juga merupakan karakteristik pembakaran.
Sumbu x menunjukkan jalur reaksi pembakaran, dan sumbu y menunjukkan energi. – energi awal rata-rata komponen yang bereaksi, – energi rata-rata produk pembakaran.
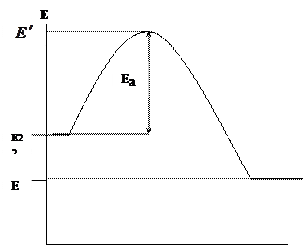 |
Gambar 1.1. Perubahan energi reaktan dan produk reaksi selama pembakaran
Mekanisme pembakaran difusi biasanya diamati ketika tekanan rendah. Pembakaran banyak digunakan dalam teknologi untuk menghasilkan panas di tungku, oven, dan ruang bakar mesin. Yang sering disebut pembakaran difusi sering digunakan, di mana difusi api terjadi melalui difusi timbal balik atau turbulen antara bahan bakar dan oksidator.
Segala bentuk pembakaran dicirikan oleh dua tahap tipikal: penyalaan dan pembakaran selanjutnya dari suatu zat menjadi produk pembakaran sempurna. Waktu yang dihabiskan pada kedua tahap adalah total waktu pembakaran. Tantangan utama teknologi pembakaran adalah mencapai total waktu pembakaran minimum dengan pembakaran semaksimal mungkin. Dalam pembakaran industri, proses fisik pembuatan campuran sangatlah penting. Karakteristik termodinamika utama campuran bahan bakar adalah nilai kalor dan temperatur pembakaran teoritis, yaitu temperatur yang dapat dicapai selama pembakaran sempurna tanpa kehilangan panas.
Hanya partikel aktif bahan bakar dan oksidator yang akan masuk ke dalam reaksi pembakaran, yang akan memiliki energi yang diperlukan untuk berinteraksi, yaitu. mampu mengatasi hambatan energi. Kelebihan energi partikel aktif dibandingkan energi rata-rata disebut energi aktivasi. Karena reaksi yang terjadi selama pembakaran bersifat eksotermik ![]() . Perbedaan energi antara produk pembakaran yang dihasilkan dan zat awal (bahan bakar dan oksidator) menentukan efek termal dari reaksi:
. Perbedaan energi antara produk pembakaran yang dihasilkan dan zat awal (bahan bakar dan oksidator) menentukan efek termal dari reaksi:
Tergantung pada keadaan agregasi bahan bakar dan oksidator, perbedaan dibuat antara pembakaran homogen, yaitu pembakaran gas dan bahan bakar yang diuapkan dalam lingkungan pengoksidasi gas; pembakaran bahan peledak dan bubuk; dan pembakaran heterogen, yaitu pembakaran bahan bakar cair dan padat dalam lingkungan pengoksidasi gas atau pembakaran dalam sistem dengan cairan campuran bahan bakar dan zat pengoksidasi cair.
Kasus pembakaran homogen yang paling sederhana adalah pembakaran campuran siap pakai. Reaksi pada dasarnya adalah reaksi berantai. Dalam kondisi pembakaran normal, faktor penentu dalam perkembangan reaksi berantai adalah pemanasan awal suatu zat. Gelombang energi awal, paling sering memanaskan bahan bakar, diperlukan untuk memulai pembakaran. Ada dua metode penyalaan - pembakaran spontan dan penyalaan paksa atau peradangan.
 |
Proporsi molekul aktif meningkat seiring dengan meningkatnya suhu campuran yang mudah terbakar.
Pada Gambar 1.2. menunjukkan distribusi energi antar molekul pada suhu. Jika sepanjang sumbu energi kita menandai nilai yang sama dengan energi aktivasi, kita memperoleh fraksi molekul aktif dalam campuran pada suhu tertentu. Jika, di bawah pengaruh sumber panas, suhu campuran meningkat hingga suatu nilai tertentu, maka proporsi molekul aktif juga akan meningkat, dan karenanya laju reaksi pembakaran.
Masalah terpenting dalam teori pembakaran adalah penyebaran api. Perbedaan dibuat antara perambatan api normal atau deflagrasi, di mana proses utamanya adalah perpindahan panas, dan detonasi, di mana gelombang kejut menyebabkan penyalaan. Pembakaran normal dibagi menjadi tipe laminar dan turbulen.
Nyala api laminar memiliki kecepatan maju tertentu relatif terhadap gas diam; kecepatannya bergantung pada komposisi campuran, tekanan dan suhu dan hanya ditentukan oleh kinetika kimia dan perpindahan panas molekul. Ini kecepatan biasa adalah konstanta fisikokimia campuran.
Namun, ada reaksi kimia yang tidak memerlukan pemanasan awal yang signifikan untuk berkembang. Ini adalah reaksi berantai.
Dasar dari teori reaksi berantai adalah asumsi bahwa zat awal tidak langsung diubah menjadi produk akhir, tetapi dengan pembentukan produk antara yang aktif.
Produk dari reaksi kimia primer memiliki persediaan energi yang besar, yang dapat hilang di ruang sekitarnya selama tumbukan molekul produk reaksi atau karena radiasi, atau dapat ditransfer ke molekul komponen yang bereaksi, mentransfernya. ke keadaan aktif. Molekul aktif (atom, radikal) zat yang bereaksi menghasilkan rantai reaksi di mana energi ditransfer dari satu molekul ke molekul lainnya. Oleh karena itu, reaksi seperti ini disebut reaksi berantai.
Laju penyebaran nyala api turbulen bergantung pada kecepatan aliran serta derajat dan derajat turbulensi. Pembakaran aliran - membakar aliran saat keluar dari pipa ke ruang atau ruang terbuka - merupakan bentuk pembakaran yang sangat umum dalam bidang teknik. Dibedakan antara pembakaran campuran yang telah disiapkan sebelumnya dan bahan bakar serta oksidator, yang mengalir secara terpisah, dimana prosesnya disebabkan oleh pencampuran kedua aliran tersebut.
Pertanyaan tentang menjaga nyala api di atas kompor atau di dalam ruangan sangatlah penting signifikansi praktis pada kondisi aliran pembakaran. Masalahnya biasanya diselesaikan dengan menyalakan campuran secara terus-menerus dengan alat khusus, atau dengan memasukkan benda-benda beraliran lemah yang tegak lurus terhadap aliran, yang memberikan sirkulasi balik produk pembakaran panas.

Molekul, atom, radikal yang aktif secara kimia yang terbentuk pada tahap dasar reaksi berantai - hubungan rantai - disebut pusat aktif. Sebagian besar pusat aktif terdiri dari atom dan radikal yang paling reaktif. Namun akibatnya mereka juga menjadi tidak stabil, karena dapat masuk ke dalam reaksi rekombinasi dengan pembentukan produk dengan aktivitas rendah.
Pembakaran bahan peledak adalah penyebaran sendiri zona reaksi kimia eksotermik penguraian bahan peledak atau interaksi komponen-komponennya dengan melewatkan energi reaksi dalam bentuk panas dari lapisan ke lapisan. Ketika produk pembakaran berbentuk gas dapat mengalir bebas dari muatan panas, pembakaran bahan peledak, tidak seperti ledakannya, biasanya tidak disertai dengan peningkatan tekanan dan tidak bersifat ledakan. Bahan peledak kental seperti campuran bahan bakar gas dan zat pengoksidasi, tidak memerlukan pasokan oksigen eksternal.
Panjang rantai yang dibentuk oleh satu pusat aktif awal bisa mencapai beberapa ratus ribu unit. Pola kinetik reaksi berantai sangat bergantung pada berapa banyak pusat aktif yang terbentuk dalam satu mata rantai. Jika dengan partisipasi pusat aktif awal hanya satu pusat aktif yang terbentuk, maka reaksi berantai tersebut disebut tidak bercabang, tetapi jika dua atau lebih pusat aktif terbentuk dalam satu mata rantai, maka reaksi berantai tersebut disebut reaksi berantai. bercabang. Laju reaksi berantai bercabang meningkat seperti longsoran salju, yang menjadi penyebab percepatan diri reaksi oksidasi kimia selama pembakaran, karena sebagian besar dicirikan oleh mekanisme reaksi berantai bercabang.
Laju pembakaran bergantung pada sifat bahan peledak, serta tekanan, suhu, kepadatan muatan, dan faktor lainnya; pada tekanan atmosfer bervariasi dari sepersekian milimeter hingga beberapa meter per detik, tergantung pada bahan peledaknya. Untuk bahan peledak bubuk biasanya puluhan dan ratusan kali lebih besar dibandingkan bahan peledak sekunder.
Proses penguapan sangat penting untuk pembakaran cairan. Pembakaran bahan bakar yang sangat mudah menguap dalam praktiknya berhubungan dengan pembakaran homogen, karena bahkan sebelum pembakaran bahan bakar tersebut menguap seluruhnya atau hampir seluruhnya. Ada dua sifat yang berlaku pada bahan bakar cair: titik nyala dan suhu penyalaan otomatis normal.
Hampir semua reaksi pembakaran secara bersamaan dapat memiliki tanda-tanda mekanisme reaksi termal dan berantai. Nukleasi pusat aktif pertama dapat bersifat termal, dan reaksi partikel aktif melalui mekanisme rantai menyebabkan pelepasan panas, pemanasan campuran yang mudah terbakar, dan nukleasi termal pusat aktif baru.
Sistem tetesan yang sangat tersebar, di mana hukum penyalaan dan pembakaran setiap tetesan sangat penting, adalah sistem cairan heterogen yang tersebar luas. Berbeda dengan pembakaran homogen, tahap penyalaan memainkan peran yang relatif kecil.
Dalam kasus yang paling sederhana, pembakaran padatan tidak disertai dengan penguraian suatu zat dan pelepasan zat-zat yang mudah menguap. Pembakaran bahan bakar padat, terutama batubara, yang terdiri dari karbon dengan sejumlah bahan organik yang terurai ketika bahan bakar dipanaskan dan dipisahkan menjadi uap dan gas, memiliki nilai yang besar dalam teknologi. Bagian bahan bakar yang tidak stabil secara termal disebut mudah menguap, dan gasnya disebut mudah menguap. Jika partikel bahan bakar memanas dengan cepat, seperti yang mungkin terjadi pada partikel kecil, zat yang mudah menguap mungkin tidak dapat dilepaskan dan dapat terbakar bersama dengan karbon.
Setiap reaksi berantai terdiri dari tahap dasar inisiasi, kelanjutan, dan penghentian rantai.
Inisiasi rantai merupakan reaksi endotermik. Pembentukan radikal bebas (yaitu atom atau kelompok atom yang mempunyai valensi bebas, misalnya ![]() ) dari molekul zat awal, mungkin sebagai akibat interaksi monomolekul atau bimolekuler, serta akibat pengaruh asing pada campuran yang mudah terbakar - inisiasi.
) dari molekul zat awal, mungkin sebagai akibat interaksi monomolekul atau bimolekuler, serta akibat pengaruh asing pada campuran yang mudah terbakar - inisiasi.
Dengan pemanasan lambat, perubahan nyata pada tahap awal pembakaran diamati: pertama, zat yang mudah menguap dipisahkan dan dinyalakan, dan kemudian terjadi penyalaan dan pembakaran zat padat, yang disebut kokas, residu yang, selain karbon, mengandung bagian anorganik dari bahan bakar.
Pembakaran katalitik atau, lebih tepatnya, pembakaran katalitik permukaan dari campuran gas termasuk dalam kelas proses pembakaran homogen-heterogen: proses kimia dapat terjadi baik di dalam volume maupun pada permukaan padat katalitik. Tergantung pada kondisi sebenarnya, jenis pembakaran yang homogen atau heterogen dapat terjadi. Pada suhu tinggi, ketika pembakaran volumetrik terjadi dengan cepat, porsi pembakaran yang dikatalisis permukaan biasanya kecil dan hanya terlihat jika campuran mengalir melalui saluran kecil, bahan berpori, atau partikel kecil.
Inisiasi dapat dilakukan dengan menambahkan zat khusus - penggagas, dengan mudah membentuk radikal bebas (misalnya peroksida, gas reaktif), di bawah pengaruh radiasi pengion, di bawah pengaruh cahaya - inisiasi fotokimia. Misalnya interaksi hidrogen dengan klor
![]()
Klasifikasi proses pembakaran
Istilah “pembakaran tanpa api” dari campuran gas, yang digunakan dalam teknologi, tidak selalu sesuai dengan gagasan pembakaran katalitik permukaan; sebaliknya, ini merupakan karakteristik pembakaran tanpa nyala api yang menyala. Pembakaran gas, cairan atau padat, di mana bahan bakar teroksidasi, menghasilkan panas, dan sering kali bersinar.
Pembakaran zat apa pun dalam bentuk gas, cair, atau padat. Dalam definisi luasnya, pembakaran melibatkan reaksi kimia eksotermik yang cepat, biasanya dalam fase gas, namun tidak termasuk reaksi karbon padat dengan oksidator gas. Nyala api merupakan reaksi pembakaran yang dapat merambat melalui ruang dengan kecepatan subsonik dan disertai dengan pancaran cahaya. Nyala api adalah hasil interaksi kompleks proses kimia dan fisika, yang deskripsi kuantitatifnya harus didasarkan pada berbagai disiplin ilmu seperti kimia, termodinamika, hidrodinamika, dan fisika molekuler.
dalam kondisi normal, prosesnya berlangsung sangat lambat, dan dalam pencahayaan yang kuat ( sinar matahari, pembakaran magnesium) berlangsung dengan ledakan.
Untuk reaksi kelanjutan rantai Ini adalah tahap dasar dari reaksi berantai yang berlanjut dengan pelestarian valensi bebas dan mengarah pada konsumsi zat awal dan pembentukan produk reaksi.
Selama reaksi kimia, energi dilepaskan dalam bentuk panas, atom dan radikal bebas terbentuk, semuanya merupakan zat antara yang sangat reaktif dalam reaksi pembakaran. Proses fisik yang terkait dengan pembakaran, pertama-tama, adalah proses transportasi: transfer massa dan energi, serta ke dalam sistem dengan aliran reagen, transfer momentum. Reaktan dalam reaksi kimia biasanya berupa bahan bakar dan oksidator. Dalam sistem pembakaran praktis, reaksi kimia merupakan hal yang utama bahan kimia, karbon dan hidrogen dalam bahan bakar dan oksigen di udara meningkat dengan cepat pada suhu tinggi karena laju reaksi meningkat secara eksponensial seiring dengan peningkatan suhu.
inisiasi rantai:
![]()
cabang rantai:
![]()
![]()
sirkuit terbuka:
homogen
![]()
heterogen
Selama pengembangan rantai, ketika konsentrasi pusat aktif menjadi cukup besar, dimungkinkan untuk membentuk suatu hubungan di mana pusat aktif akan bereaksi tanpa menghasilkan pusat aktif baru. Fenomena ini disebut rangkaian terbuka.
Sirkuit terbuka bisa homogen dan heterogen.
Pemutusan rantai homogen dimungkinkan baik selama interaksi radikal atau atom satu sama lain untuk membentuk produk yang stabil, atau selama reaksi pusat aktif dengan molekul asing pada proses utama tanpa pembentukan pusat aktif baru.
Pemutusan rantai heterogen terjadi pada dinding bejana tempat reaksi pembakaran terjadi atau pada permukaan mikropartikel padat yang ada dalam fase gas, kadang-kadang dimasukkan secara khusus (misalnya, seperti pada pemadaman dengan bubuk). Mekanisme terminasi rantai heterogen dikaitkan dengan adsorpsi pusat aktif pada permukaan partikel atau bahan padat. Laju terminasi rantai heterogen sangat bergantung pada rasio luas permukaan dinding dengan volume bejana tempat terjadinya pembakaran. Dengan demikian, pengurangan diameter bejana secara signifikan mengurangi laju reaksi pembakaran hingga penghentian totalnya. Penciptaan alat penahan api didasarkan pada hal ini.
Contoh reaksi berantai bercabang adalah pembakaran hidrogen dalam oksigen.
inisiasi rantai:
![]()
cabang rantai:
![]()
![]()
sirkuit terbuka:
homogen
![]()
heterogen
Pembakaran hidrokarbon
Pertimbangan proses pembakaran hidrogen dan karbon monoksida menunjukkan rumitnya mekanisme reaksi pembakaran. Dalam kasus H 2 dan CO, reaksi berlangsung sebagai reaksi berantai yang melibatkan banyak tahap dasar dan produk antara. Oleh karena itu, wajar jika mekanisme reaksi pembakaran zat dengan struktur yang lebih kompleks - hidrokarbon - menjadi lebih kompleks dan efek yang menyertai proses penyalaan dan pembakaran senyawa tersebut lebih beragam.
Informasi yang tersedia saat ini tentang sifat transformasi kimia hidrokarbon selama pembakarannya memungkinkan untuk menjelaskan efek yang diamati dengan beberapa perkiraan.
Telah ditetapkan bahwa dalam nyala hidrokarbon, bersama dengan partikel aktif H×, OH×, O×, jumlah besar produk antara dari struktur yang lebih kompleks. Dalam beberapa kasus, mereka menjadi sumber munculnya rantai baru. Peran utama dalam proses penyalaan dan pembakaran hidrokarbon dimainkan oleh jenis berikut koneksi perantara:
1. Radikal hidrokarbon, yaitu molekul hidrokarbon yang satu atau lebih atom hidrogennya telah dihilangkan. Residu ini disebut alkil (CH3 - metil; C 2 H 5 - etil; C 3 H 7 - propil, dll.). Karena reaktivitasnya yang tinggi, alkil tidak ada dalam bentuk bebas untuk waktu yang lama. Hadir dalam api sebagai produk antara. Ketika berinteraksi dengan molekul lain, mereka berperilaku sebagai kelompok struktural independen. Radikal hidrokarbon
biasanya dilambangkan dengan huruf R.
2. Peroksida - senyawa rumus umum R-OO-R'.
3. Aldehida - jenis senyawa
Aldehida yang paling sederhana adalah format (formaldehida) HCOOH dan asetat (asetaldehida) CH 3 COH. Zat-zat ini selalu ada dalam produk pembakaran hidrokarbon yang tidak sempurna.
Setiap reaksi di mana radikal hidrokarbon terbentuk dapat memulai rantai selama pembakaran hidrokarbon. Ini mungkin reaksi penguraian molekul etana dengan pembentukan dua gugus metil bebas:
C 2 H 6 ® ×CH 3
atau reaksi hidrokarbon dengan oksigen:
RH + O 2 ® ×H2O 2 + ×R
Kelanjutan rantai terjadi sebagai akibat dari reaksi pembentukan | peroksida atau hidroperoksida:
R + O 2 ® ROO×
ROO× + RH ® ROOH + R×
Percabangan rantai terjadi selama penguraian hidroperoksida:
ROOH ® ×RO + ×OH
Urutan reaksi di atas menyebabkan peningkatan bertahap dalam konsentrasi senyawa peroksida dalam sistem reaksi.
Bersamaan dengan akumulasi peroksida, radikal, ×OH dan ×H, reaksi paralel mulai terjadi:
ROOH + ×OH ® ROO× + H 2 O
Reaksi-reaksi ini bersifat eksotermik; Ketika hal itu terjadi, sejumlah besar panas dilepaskan.
Dengan meningkatnya suhu campuran yang bereaksi, peran pusat aktif berpindah dari satu produk antara ke produk antara lainnya dengan urutan sebagai berikut: alkil hidroperoksida, asil hidroperoksida, aldehida.
Studi eksperimental Perubahan komposisi campuran yang bereaksi terhadap waktu pada daerah suhu tinggi (600-800°C) menunjukkan bahwa proses pengubahan hidrokarbon awal menjadi hasil pembakaran akhir CO 2 dan H 2 O terbagi menjadi dua tahap: pada tahap pertama, yang terjadi dengan kecepatan sangat tinggi, terjadi oksidasi hidrokarbon menjadi CO. Pada tahap kedua, tahap lambat, CO dioksidasi menjadi CO2
Pengaruh berbagai faktor terhadap laju reaksi kimia selama pembakaran
Ketergantungan laju reaksi pembakaran pada konsentrasi reaktan dapat direpresentasikan dengan persamaan
![]() (1)
(1)
dimana: k 0 – konstanta laju reaksi,
Dari pegunungan - konsentrasi zat mudah terbakar, kmol/m 3,
C ok – konsentrasi zat pengoksidasi, kmol/m3,
x,y – orde reaksi masing-masing untuk bahan bakar dan oksidator.
Seperti disebutkan di atas, persamaan reaksi keseluruhan (1) tidak mencerminkan mekanisme reaksi pembakaran yang sebenarnya, yaitu multi tahap dan seringkali berantai, oleh karena itu orde reaksi pada persamaan (2) tidak selalu sesuai dengan nilainya. koefisien stoikiometri pada persamaan (1).
Oleh karena itu, semakin tinggi konsentrasi zat yang mudah terbakar, semakin tinggi pula laju pembakarannya.
Laju reaksi pembakaran bergantung pada suhu:
e – basis logaritma natural
E a – energi aktivasi, kJ/kmol,
R – konstanta gas universal, R=8,314 kJ/(K.kmol)
T – suhu, K.
Persamaan ini merupakan ekspresi hukum Arrhenius tentang ketergantungan laju reaksi kimia terhadap suhu. Dalam bentuk yang disederhanakan, untuk rentang suhu yang sempit, Anda dapat menggunakan aturan van't Hoff: laju reaksi kimia meningkat 2-4 kali lipat dengan peningkatan suhu setiap 10 0.
Jadi, laju reaksi kimia oksidasi zat yang mudah terbakar selama pembakaran meningkat tajam seiring dengan meningkatnya suhu, dan semakin besar laju, semakin rendah energi aktivasi.
Laju reaksi oksidasi selama pembakaran juga bergantung pada tekanan.
Peningkatan tekanan menyebabkan peningkatan konsentrasi volume zat gas yang mudah terbakar dan zat pengoksidasi. Dalam praktiknya, hal ini mengarah pada fakta bahwa dengan meningkatnya tekanan, laju reaksi pembakaran sebagian besar zat meningkat.
Pada tekanan tinggi nyala api panas muncul.
Seperti disebutkan di atas, reaksi oksidasi kimia sangat eksotermik, oleh karena itu pembakaran disertai dengan pelepasan sejumlah besar panas dan oleh karena itu berlangsung pada suhu suhu tinggi. Misalnya, suhu pembakaran kayu adalah 700-800 0 C, produk minyak bumi - bahkan lebih tinggi - 1300-1500 0 C.
Pada tekanan rendah, api dingin dapat terjadi. Akselerasi diri dari reaksi berantai kimia pembakaran terjadi dalam mode isotermal. Hal ini terjadi pada komposisi tertentu dari campuran yang mudah terbakar dan keadaan lingkungan tertentu. Percepatan diri isotermal merupakan karakteristik campuran dengan konsentrasi produk antara aktif yang cukup tinggi, tetapi produk antara yang cukup stabil, yang menyebabkan penurunan percabangan rantai, dan akibatnya menyebabkan penurunan pelepasan panas, yang disebabkan oleh pembuangan panas. dibuang ke lingkungan dan sebagian digunakan untuk memanaskan produk antara yang stabil. Cahaya muncul, yaitu chemiluminescence, dan bukan radiasi termal produk pembakaran panas yang terjadi dalam nyala api panas.
Selain itu, munculnya api dingin sangat dipengaruhi oleh dinding bejana tempat terjadinya pembakaran. Mereka memiliki efek katalitik pada proses penghancuran pusat aktif, mis. terminasi rantai heterogen terjadi. Intensitas proses ini ditentukan oleh laju difusi pusat aktif ke dinding bejana. Penurunan tekanan mendorong proses ini. Penurunan tekanan tidak hanya dapat menyebabkan terbentuknya nyala api dingin, bukan nyala api panas, tetapi dalam kondisi tertentu (misalnya, dalam bejana sempit) bahkan pembakaran terhenti total.
Seperti disebutkan di atas, transformasi kimia selama proses pembakaran menyebabkan munculnya berbagai proses fisik: perpindahan panas karena konveksi, konduktivitas termal dan radiasi, perpindahan zat yang bereaksi, dll.
Dengan demikian, pembakaran dapat dicirikan sebagai proses fisikokimia kompleks yang mandiri, yang dicirikan oleh tiga karakteristik: transformasi kimia, pelepasan panas dan radiasi (termasuk, paling sering, cahaya, yaitu di bagian spektrum yang terlihat). Tidak adanya tanda-tanda tersebut menunjukkan bahwa proses yang dimaksud tidak berhubungan dengan pembakaran, misalnya “pembakaran” bola lampu listrik (tidak terjadi transformasi kimia), korosi pada logam (tidak ada emisi cahaya dan emisi panas praktis tidak signifikan), dll.
Bagikan dengan TEMAN:Pembakaran selalu disertai dengan transformasi kimia. Pembakaran di udara adalah interaksi zat yang mudah terbakar dengan oksigen. Namun perlu diingat bahwa nitrogen oksida, halogen, dan ozon dapat berperan sebagai zat pengoksidasi dalam proses pembakaran. Proses pembakaran diketahui terjadi dengan partisipasi hanya satu produk awal - senyawa yang mampu terurai dengan cepat. Contoh senyawa tersebut adalah asetilena dan hidrazin.
Proses kimia yang terjadi selama pembakaran sangatlah kompleks. Bahkan untuk kasus yang paling sederhana - pembakaran hidrogen dalam oksigen, persamaan umum yang berbentuk
2H 2 + 0 2 = 2H 2 0,
Beberapa lusin tahapan dasar telah ditetapkan dan dipelajari.
Sampai saat ini, mekanisme transformasi kimia selama pembakaran hanya beberapa zat telah dipelajari dengan cukup rinci: hidrogen, karbon monoksida, metana, dan etana. Pengetahuan ini digunakan untuk memprediksi kondisi penyalaan dan pembakaran banyak zat.
2.1. Reaksi berantai
Reaksi berantai, tidak seperti transformasi kimia biasa, dicirikan oleh munculnya partikel aktif dalam setiap tindakan dasar: atom dengan elektron tidak berpasangan, radikal bebas, atau ion. Munculnya partikel aktif menyebabkan terjadinya rantai transformasi zat awal menjadi produk reaksi. Atom, radikal bebas, dan ion lebih reaktif dibandingkan molekul jenuh valensi. Oleh karena itu, meskipun diperlukan biaya energi yang signifikan untuk memutus ikatan kimia dan membentuk partikel aktif, perkembangan rantai suatu reaksi sering kali lebih menguntungkan secara energetik daripada interaksi langsung antar molekul.
Proses pembakaran terutama terjadi melalui mekanisme rantai. Reaksi berantai merupakan reaksi kompleks yang terjadi dalam beberapa tahap, yaitu:
Nukleasi rantai (inisiasi), di mana partikel aktif terbentuk;
Kelanjutan rantai, di mana partikel aktif masuk ke dalam interaksi kimia dengan zat asli, sehingga terbentuk partikel aktif baru;
Penghentian rantai, di mana “kematian” partikel aktif terjadi dengan pembentukan produk reaksi akhir
Inti rantai dapat terjadi dalam berbagai kondisi. Misalnya, akibat disosiasi molekul di bawah pengaruh energi panas, atau radiasi pengion, dalam pelepasan listrik. Kematian partikel aktif terjadi selama rekombinasi*, selama interaksi radikal bebas (penghentian rantai homogen), selama interaksi partikel aktif dengan permukaan padat (penghentian rantai heterogen) atau sebagai akibat reaksinya dengan penghambat pembakaran.
Ada reaksi berantai tidak bercabang dan bercabang. Pada partikel tidak bercabang, untuk setiap partikel aktif yang dikonsumsi dalam reaksi berantai lanjutan, terdapat satu partikel baru yang muncul. Jumlah molekul produk yang terbentuk per partikel aktif awal disebut panjang rantai. Panjang rantai pada reaksi pembakaran berkisar antara ratusan ribu hingga puluhan juta. Laju reaksi berantai tidak bercabang dapat dipengaruhi oleh pengotor kecil zat yang mampu berinteraksi secara efektif dengan partikel aktif - penghambat pembakaran.
Beberapa zat - inisiator - memfasilitasi pembentukan partikel aktif dan dengan demikian mempercepat reaksi berantai tidak bercabang.
Dalam reaksi berantai bercabang, satu partikel aktif, yang dikonsumsi seiring kelanjutan rantai, menghasilkan dua atau lebih partikel aktif. Salah satunya melanjutkan rantai utama, sementara yang lain memulai rantai baru, membentuk cabang (Gbr. 2.1).
“Rekombinasi adalah proses pembentukan atom atau molekul netral dari partikel bermuatan. Atom dan molekul yang terbentuk selama rekombinasi dapat berada dalam keadaan dasar atau tereksitasi.
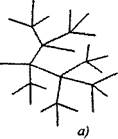
Beras. 2.1. Ilustrasi skema rantai reaksi:
a) bercabang pada setiap mata rantai
6) percabangan yang jarang
Misalnya, saat membakar hidrogen dalam reaksi berantai nukleasi:
atom aktif terbentuk. Dalam reaksi lanjutan berantai:
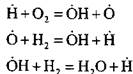
terjadi peningkatan jumlah atom aktif, yang merupakan awal dari rantai baru.
Reaksi berantai bercabang dapat terjadi dalam mode stasioner, di mana laju percabangan lebih kecil daripada laju kematian partikel aktif, dan dalam mode non-stasioner, di mana kematian terjadi lebih lambat daripada percabangan. Dalam kasus terakhir, laju reaksi berantai meningkat secara eksponensial dan hanya dibatasi oleh konsumsi zat awal. Transisi dari mode stasioner ke non-stasioner terjadi secara tiba-tiba dengan sedikit perubahan kondisi reaksi: suhu, tekanan atau konsentrasi salah satu reaktan. Percepatan cepat seperti itu dianggap sebagai penyalaan spontan campuran reaksi atau ledakan berantai.
Penemuan reaksi berantai bercabang telah sangat penting untuk membuat teori proses pembakaran. Terbukti ada dua jenis pengapian: termal dan rantai. Pola yang terbentuk pada
Bab 2. Proses kimia selama pembakaran
teori proses rantai, memungkinkan Anda untuk secara efektif mempengaruhi perkembangan dan penekanan proses pembakaran jika terjadi kebakaran.
Asal usul rantai. Proses nukleasi pusat aktif awal memainkan peran penting dalam pengembangan reaksi berantai tidak bercabang. Ini mengkompensasi hilangnya pusat aktif selama reaksi penghentian berantai. Mekanisme ini menentukan kondisi pembentukan rezim stasioner selama periode awal akumulasi pusat aktif. Pada tingkat inisiasi yang rendah, periode ini bisa menjadi signifikan.
Sebagian besar reaksi kimia dalam nyala api dibedakan oleh cadangan energi pusat aktif yang signifikan. Dalam kondisi ini, permulaan pusat aktif dikaitkan dengan mengatasi hambatan energi yang signifikan.
Dalam hal ini, peran penting dimainkan oleh faktor-faktor yang memastikan tingkat pembentukan pusat aktif yang signifikan: bahan tambahan aktif secara kimia, radiasi, pelepasan listrik, produk peluruhan radioaktif.
Di antara faktor-faktor yang secara signifikan memfasilitasi pembentukan pusat aktif, reaksi heterogen harus diperhatikan. Dalam molekul zat mudah terbakar yang teradsorpsi pada permukaan padat, ikatan antar atom melemah dan lebih sedikit energi yang dibutuhkan untuk memutusnya. Dalam kondisi ini, laju pembentukan pusat aktif jauh lebih tinggi dibandingkan dengan volume gas. Energi aktivasi selama interaksi heterogen komponen campuran yang mudah terbakar juga lebih rendah dibandingkan dengan interaksi homogen. Inisiasi heterogen dari pusat aktif dalam kondisi proses pembakaran nyata merupakan faktor penting dalam percepatan pencapaian rezim stasioner dalam proses rantai tidak bercabang.
Beberapa ciri menjadi ciri reaksi berantai tidak bercabang yang terjadi dengan partisipasi komponen atom. Dengan tidak adanya pengotor yang berinteraksi dengan pusat aktif tanpa regenerasi, pemutusan rantai hanya mungkin terjadi melalui rekombinasi atom melalui tumbukan rangkap tiga dan di permukaan.
Pada suhu berapa pun, semua zat gas terdisosiasi sebagian. Beberapa molekul terurai menjadi atom. Dalam hal ini terjadi keseimbangan antara proses disosiasi dan penggabungan atom menjadi molekul. Derajat disosiasi bergantung secara eksponensial pada suhu.
Jika tidak ada pengotor pemutus rantai dalam campuran yang mudah terbakar, maka konsentrasi komponen atom reaksi praktis tidak berubah. Atom-atom yang masuk ke dalam reaksi segera diregenerasi dalam ko-
Korolchenko A.Ya. Proses pembakaran dan ledakan
kepribadian. Inisiasi awal mengkompensasi atom-atom yang bereaksi dalam jumlah yang sama seperti pada sistem yang tidak bereaksi. Reaksi stasioner tidak mempengaruhi proses ini. Kesetimbangan salah satu komponen reaksi, yang ditandai dengan lemahnya ikatan antar atom dalam molekul, adalah fitur karakteristik rezim serupa. Konsentrasi komponen atom lainnya bersifat kuasi-stasioner, tetapi lebih besar dari konsentrasi kesetimbangan.
Dengan permulaan reaksi pembakaran yang homogen, keadaan stasioner akan terbentuk hanya setelah jangka waktu tertentu, karena disosiasi memerlukan energi aktivasi yang besar. Selama periode ini, laju disosiasi melebihi laju rekombinasi, dan pusat aktif terakumulasi dalam sistem yang bereaksi. Laju kedua proses tersebut dibandingkan hanya setelah konsentrasi pusat aktif ditingkatkan hingga mencapai kesetimbangan. Periode waktu ini disebut periode induksi.
Kehadiran permukaan padat sebagai katalis dalam zona reaksi tidak mengubah keadaan kesetimbangan termodinamika. Katalis mempengaruhi reaksi maju dan mundur secara seimbang. Pusat-pusat aktif tidak hanya berinti pada permukaan padat, tetapi juga berakhir di sana. Namun, kehadiran katalis mempercepat pencapaian keadaan keseimbangan disosiasi.
Jika campuran yang mudah terbakar mengandung pengotor aktif yang dapat berpartisipasi dalam reaksi terminasi berantai, maka konsentrasi pusat aktif akan berkurang. Dalam hal ini, disosiasi kesetimbangan salah satu komponen awal terganggu, yang memperlambat reaksi dan dapat menyebabkan penghentiannya.
Eksperimen menunjukkan bahwa ketika reaksi berantai tidak bercabang diprakarsai oleh sumber eksternal (misalnya, sumber cahaya), konsentrasi pusat aktif pada tahap awal perkembangan proses pembakaran dapat secara signifikan melebihi konsentrasi kesetimbangan.
Ketika reaksi berantai bercabang terjadi, kondisi inisiasi awal mempunyai pengaruh yang signifikan terhadap perkembangan reaksi. Dalam proses yang berkembang lambat, menambahkan campuran yang bereaksi sebagian ke campuran asli akan memperpendek periode induksi dan mempercepat momen pembakaran yang menyala.
Kelanjutan rantai. Ciri khas reaksi berantai tidak bercabang adalah sifat kuasi-stasioner dari konsentrasi pusat aktif. Dengan tidak adanya pemutusan rantai, partikel aktif terbentuk
Bab 2. Proses kimia selama pembakaran
jumlah yang sama dengan yang dikonsumsi. Yang baru muncul hanya pada inisiasi awal. Ketika laju pembangkitan pusat aktif dan penghentian rantai sama, konsentrasi pusat aktif yang konstan dan mode reaksi stasioner akan terbentuk. Laju reaksi akan menurun seiring dengan habisnya komponen awal.
Dalam kasus reaksi berantai bercabang, konsentrasi pusat aktif dalam sistem reaksi meningkat terlepas dari kondisi permulaannya. Mode reaksi percepatan diri diwujudkan, yang memiliki karakter seperti longsoran salju. Dalam hal ini, satu pusat aktif awal cukup untuk mengubah seluruh komponen awal menjadi produk reaksi akhir.
Persamaan kinetik reaksi berharga bercabang adalah sebagai berikut. Perubahan konsentrasi komponen awal yang stabil dari waktu ke waktu dapat diabaikan sebagai perkiraan pertama, dan hanya perubahan yang lebih cepat dalam konsentrasi pusat aktif yang dapat diperhitungkan. P. Perubahan laju ini ditentukan oleh laju inisiasi awal dan rasio laju reaksi percabangan dan terminasi rantai. Kecepatan inisiasi awal tidak bergantung pada konsentrasi pusat aktif yang ada dalam sistem. Laju proses percabangan dan terminasi sebanding dengan konsentrasi pusat aktif. Dalam kondisi ini, keseimbangan keseluruhan pembentukan dan konsumsi pusat-pusat aktif ditentukan oleh jumlah tingkat proses inisiasi, percabangan dan terminasi:
![]() (2.1)
(2.1)
dimana dan adalah konstanta laju reaksi percabangan dan terminasi. Dengan menyatakan , kita mendapatkan:
![]() (2.2)
(2.2)
Bila turunan waktu dari konsentrasi pusat aktif
positif. Dalam hal ini, laju reaksi meningkat seiring waktu. Ciri reaksi berantai bercabang ini disebabkan oleh penggandaan pusat aktif pada rezim seperti itu ketika laju reaksi percabangan melebihi laju reaksi penghentian berantai.
Korolchenko A.Ya. Proses pembakaran dan ledakan
Jika sebelum dimulainya reaksi sistem tidak mengandung pusat aktif, mis. padaT= 0, n = 0 integrasi persamaan (2.2) menghasilkan:
![]() (2.3)
(2.3)
Laju total reaksi CO ditentukan oleh laju proses percabangan. Produk akhir hanya terbentuk selama reaksi ini. Untuk setiap tindakan dasar percabangan rantai, molekul produk akhir terbentuk. Dari sini berikut ini:
![]() (2.4)
(2.4)
Perkembangan reaksi berantai dari waktu ke waktu ditentukan oleh rasio konstanta laju reaksi percabangan dan terminasi rantai dan At yaitu. ketika eksponen dalam persamaan (2.4) positif dan re-
tindakan ini semakin cepat tanpa batas waktu. Pada periode awal perkembangan reaksi, perbandingan berikut ini berlaku:
Karena laju inisiasi awal yang rendah, tidak ada transformasi kimia yang nyata pada periode awal. Setelah beberapa waktu, nilainya menjadi jauh lebih besar daripada kesatuan. Setelah itu, laju reaksi, sesuai dengan persamaan (2.4), mulai meningkat dengan cepat dan mencapai nilai yang sangat tinggi, meskipun sebelumnya hampir tidak terlihat.
Adanya masa tunda (masa induksi) selama berkembangnya reaksi berantai disebabkan oleh kebutuhan untuk mengakumulasi sejumlah pusat aktif dalam sistem reaksi. Hanya setelah ini transformasi kimia menjadi nyata.
Besarnya periode induksi dalam reaksi berantai ditentukan oleh rasio laju proses percabangan dan terminasi rantai, dan bukan oleh laju inisiasi awal. Pada gilirannya, laju reaksi percabangan dan terminasi ditentukan fitur kimia masing-masing sistem bereaksi ditentukan oleh ketergantungan pada suhu dan konsentrasi komponen awal. Keunikan reaksi berantai adalah
Kuncinya adalah proses percabangan memerlukan energi aktivasi yang signifikan, sedangkan koefisien suhu dari konstanta laju proses terminasi mendekati nol. Untuk ketiga jenis reaksi terminasi berantai: selama rekombinasi massal dan heterogen, selama interaksi radikal dengan pengotor aktif, energi aktivasi sama dengan nol.
Dengan peningkatan suhu, tekanan total campuran atau perubahan konsentrasi komponen yang bereaksi, perubahan konstanta laju percabangan dan penghentian dimungkinkan, di mana reaksi berpindah dari mode stasioner ke mode non- yang stasioner. Keunikan proses ini terletak pada peralihan mendadak dari satu mode ke mode lainnya, pada perubahan laju reaksi dari nilai yang sangat kecil ke nilai yang meningkat tanpa batas.
Terjadinya beberapa reaksi berantai disertai dengan pembentukan produk antara yang relatif stabil, namun pada saat yang sama mempunyai kemampuan untuk menghasilkan pusat aktif. Reaksi tersebut mencakup, misalnya, reaksi pembakaran hidrokarbon, di mana peroksida dan aldehida terbentuk sebagai produk antara. Hal ini menyebabkan cabang rantai. Namun, karena stabilitas relatif produk antara, percepatan reaksi diperpanjang seiring waktu. Percabangan rantai yang lambat ini disebut degenerasi.
Reaksi berantai dengan mekanisme percabangan radikal yang biasa, biasanya berlangsung cukup cepat karena tingginya aktivitas radikal. Radikal yang dihasilkan akan memulai reaksi yang dipercepat dengan cepat atau bergabung kembali dan keluar dari proses.
Sirkuit rusak. Partikel aktif, seperti molekul gas lainnya, mengalami gerakan kacau dalam sistem reaksi, bertabrakan dengan molekul lain. Dalam hal ini, ada kemungkinan tertentu bahwa, selama tumbukan tertentu, terjadi interaksi dengan partikel atau molekul aktif lainnya dan pembentukan partikel aktif baru, melanjutkan jalur yang sebelumnya. Perkembangan rantai reaksi mirip dengan gerak Brown molekul inert, meskipun perpindahan pusat aktif disertai dengan reaksi kimia. Sepanjang jalur pengembangan rantai, pusat aktif dari dua jenis atau lebih bergantian.
Korolchenko A.Ya. Proses pembakaran dan ledakan
Rantai reaksi berlanjut hingga partikel aktif bereaksi tanpa regenerasi. Dalam hal ini, terjadi apa yang disebut pemutusan sirkuit. Proses terminasi memainkan peran besar dalam kinetika reaksi berantai. Ada dua kemungkinan jenis reaksi yang menyebabkan matinya pusat aktif:
Terminasi homogen (kematian volume campuran yang bereaksi);
Kerusakan sirkuit heterogen (kematian pada permukaan padat) Kerusakan sirkuit homogen terjadi dalam salah satu dari dua proses:
selama rekombinasi radikal atau selama interaksi berbagai komponen kimia aktif dengan pusat aktif tanpa regenerasi pusat aktif.
Kerusakan sirkuit heterogen terjadi pada partikel jelaga yang terbentuk selama pembakaran atau pada permukaan bahan padat yang terbakar. Pemutusan rantai pada permukaan padat dapat dianggap sebagai difusi pusat aktif dari campuran gas ke permukaan tempat mereka menghilang. Mekanisme rekombinasi pada permukaan padat adalah partikel aktif dengan reaktivitas yang meningkat diserap* pada permukaan. Radikal yang diserap di daerah tetangga bergabung kembali satu sama lain, karena tidak ada hambatan energi atau spasial untuk proses ini. Molekul senyawa stabil yang terbentuk sebagai hasil rekombinasi tidak lagi ikut serta dalam perkembangan reaksi berantai.
Namun, tidak setiap tumbukan partikel aktif dengan permukaan padat menyebabkan adsorpsi. Ini mungkin tercermin dari permukaan. Peluang adsorpsi pusat aktif oleh permukaan padat disebut koefisien akomodasi. Koefisien ini merupakan karakteristik afinitas kimia partikel aktif dan permukaan. Dalam kasus-kasus yang praktis penting, partikel aktif, setelah dipantulkan dari dinding, tidak bergerak jauh darinya. Ada kemungkinan terjadi benturan baru dengan dinding hingga terjadi akomodasi. Karena proses ini, dalam kondisi tertentu, laju reaksi praktis tidak bergantung pada koefisien akomodasi. Prosesnya berlangsung sebagai berikut:
* Penyerapan - penyerapan oleh zat padat (atau cair). lingkungan. Badan yang menyerap disebut sorben, yang diserap- sorbat. Perbedaan dibuat antara penyerapan oleh seluruh massa sorben (penyerapan) dan oleh lapisan permukaan (adsorpsi). Penyerapan karena interaksi jenis kimia antara permukaan sorben padat dan sorbat disebut kemisorpsi.
__________________________ Bab 2. Proses kimia selama pembakaran
akankah terjadi pemutusan sirkuit pada setiap tumbukan. Konsentrasi pusat aktif di permukaan dapat dianggap nol.
Dengan tidak adanya pengotor aktif dalam campuran reaksi, pemutusan rantai dapat terjadi baik pada permukaan padat atau secara homogen melalui rekombinasi radikal dalam jumlah besar. Dalam kebakaran nyata, cara kedua terutama diterapkan.
Penambahan gas inert ke sistem reaksi mempunyai pengaruh tertentu terhadap kinetika reaksi berantai. Aditif inert meningkatkan jumlah tumbukan dengan partikel aktif, meningkatkan kemungkinan putusnya rantai dan, karenanya, menghambat reaksi keseluruhan.
Penghambatan reaksi berantai yang lebih efektif dicapai dengan memasukkan aditif aktif kimia - inhibitor - ke dalam campuran reaksi. Inhibitor berinteraksi dengan pusat aktif yang memimpin reaksi, memutus rantai. Kinetika reaksi dalam campuran yang dihambat ditentukan oleh kondisi persaingan antara inhibitor dan komponen utama reaksi ketika berinteraksi dengan pusat aktif. Dengan efisiensi inhibitor yang tinggi dan kecepatan pembentukan pusat aktif baru yang moderat, penambahan inhibitor dalam jumlah kecil pun dapat sepenuhnya menekan reaksi berantai.
Proses penghambatan sangat penting dalam praktik keselamatan kebakaran dan ledakan. Penggunaan inhibitor memungkinkan untuk mempengaruhi proses pembakaran secara efektif.
2.2. Proses kimia selama pembakaran hidrogen
Interaksi molekul hidrogen dengan molekul oksigen berlangsung secara kompleks melalui sejumlah tahap yang berurutan. Sekarang telah diketahui secara pasti bahwa pembakaran hidrogen terjadi melalui mekanisme rantai, dan partikel berperan sebagai pusat aktif. Urutan dan pentingnya reaksi elementer selama pembakaran hidrogen dijelaskan dengan sangat rinci berbagai kondisi terjadinya dan perkembangan api hidrogen.
Analisis paling rinci tentang proses pembakaran hidrogen dalam mode penyalaan sendiri menggunakan metode eksperimental dan komputasi dilakukan oleh Profesor A. N. Baratov. Dia mengusulkan skema proses berikut, termasuk empat belas reaksi dasar dasar:
Korolchenko A.Ya. Proses pembakaran dan ledakan
Nukleasi pusat aktif terjadi sesuai dengan reaksi
![]()
Kelanjutan rantai melalui reaksi
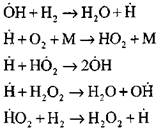
Rantai percabangan
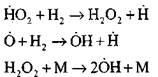 |
sirkuit rusak
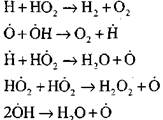 |
Konsentrasi atom hidrogen pada tahap awal proses penyalaan sendiri merupakan bagian yang tidak signifikan dari kandungan hidrogen awal. Ketika reaksi berantai berkembang, laju konversi molekul hidrogen menjadi sangat tinggi sehingga menghabiskan waktu seperseratus detik.
2.3. Reaksi kimia selama pembakaran karbon monoksida
Interaksi karbon monoksida dengan oksigen merupakan reaksi terpenting dalam proses pembakaran. Terjadinya reaksi ini di
__________________________ Bab 2. Proses kimia s saat terbakar
dalam banyak kasus hal ini menentukan pola pembakaran zat yang mengandung karbon. Reaksinya ditandai dengan mekanisme rantai bercabang. Ini berbeda dalam beberapa fitur.
Sejak lama ada kepercayaan bahwa campuran CO dan 0 2 yang benar-benar kering tidak dapat menyala dan terbakar. Namun, percobaan yang dilakukan secara hati-hati di mana ketiadaan air dipantau menggunakan spektograf massa menunjukkan bahwa penyalaan juga mungkin terjadi pada campuran kering. Perlu dicatat bahwa keberadaan air atau uap hidrogen dalam sistem CO + 0 2 mengaktifkan proses penyalaan dan pembakaran dengan meningkatkan jumlah kemungkinan pusat aktif. Efek percepatan air terutama terlihat pada konsentrasi rendah.
Pembakaran karbon monoksida dengan adanya uap air atau penambahan kecil hidrogen terjadi dengan partisipasi proses dasar berikut:

Radikal H0 2 yang terbentuk pada reaksi (VI) dapat melanjutkan rantai (reaksi VIII) atau mengakhiri reaksi (IX-XII).
Untuk menilai kondisi transisi oksidasi lambat CO menjadi ledakan berantai, kami memperkirakan kemungkinan terminasi rantai melalui radikal H0 2; Pada saat yang sama, kami memperhitungkan bahwa peran reaksi (X) dan (XI) dalam penghentian rantai tidak akan signifikan karena
dibandingkan dengan reaksi (IX), karena konstanta laju proses (IX-XI) pada suhu orde 1000 K berdekatan satu sama lain, tetapi konsentrasi radikal jauh lebih rendah daripada konsentrasi atom hidrogen, karena radikal memiliki aktivitas kimia yang lebih besar. Oleh karena itu, peluang terminasi rantai melalui radikal H0 2 dapat ditulis sebagai:
Pada suhu 1000K
Oleh karena itu, dengan syarat
![]()
![]()
pengaruh besarnya
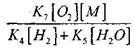
pada solusi persamaan (2.7) akan lemah.
Bab 2. Proses kimia selama pembakaran
Jika ![]() atau
atau ![]() (yang diamati di
(yang diamati di
api CO nyata), persamaan (2.7) diubah menjadi bentuk:
![]() (2.8)
(2.8)
Dengan demikian, kondisi pembakaran karbon monoksida di udara sangat ditentukan oleh keberadaan dan pola pembakaran hidrogen. Oksidasi CO melalui reaksi (I) bergantung pada konsentrasi radikal OH yang terbentuk dalam reaksi yang melibatkan hidrogen.
Keunikan reaksi pembakaran karbon monoksida adalah penghambatannya yang cepat ketika bahan tambahan kecil dengan afinitas tinggi terhadap atom hidrogen dimasukkan ke dalam sistem reaksi. Zat yang menghambat pembakaran CO adalah halogen dan turunan hidrokarbon terhalogenasi. Efek penghambatannya disebabkan oleh penghentian rantai reaksi ketika berinteraksi dengan atom hidrogen sesuai dengan reaksi yang terjadi
2.4. Pembakaran hidrokarbon
Pertimbangan proses pembakaran hidrogen dan karbon monoksida menunjukkan rumitnya mekanisme reaksi pembakaran. Dalam kasus H 2 dan CO, reaksi berlangsung sebagai reaksi berantai yang melibatkan banyak tahap dasar dan produk antara. Oleh karena itu, wajar jika mekanisme reaksi pembakaran zat dengan struktur yang lebih kompleks - hidrokarbon - menjadi lebih kompleks dan efek yang menyertai proses penyalaan dan pembakaran senyawa tersebut lebih beragam.
Informasi yang tersedia saat ini tentang sifat kelebihan kimia hidrokarbon selama pembakarannya memungkinkan untuk menjelaskan efek yang diamati dengan beberapa perkiraan.
Telah ditetapkan bahwa dalam nyala hidrokarbon, bersama dengan partikel aktif yang sudah diketahui, terdapat sejumlah besar produk antara dengan struktur yang lebih kompleks. Dalam beberapa kasus, mereka menjadi sumber munculnya rantai baru. Peran utama dalam proses penyalaan dan pembakaran hidrokarbon dimainkan oleh jenis senyawa antara berikut:
Korolchenko A.Ya. Proses pembakaran dan ledakan
1. Radikal hidrokarbon, yaitu molekul karbon
hidrogen klorida yang satu atau lebih atom hidrogennya telah dihilangkan. Ini
residunya disebut alkil (CH3 - metil; C2H5 - etil; C3H7 - propil dan
dll.). Karena tingginya reaktivitas alkil dalam bentuk bebas
tidak ada untuk waktu yang lama. Hadir dalam api sebagai perantara
produk baru. Ketika berinteraksi dengan molekul lain, mereka berperilaku
sebagai kelompok struktural yang independen. Radikal hidrokarbon
biasanya dilambangkan dengan huruf R.
2. Peroksida adalah senyawa dengan rumus umum R-00-R."
3. Aldehida - jenis senyawa
![]()
Aldehida yang paling sederhana adalah format (formaldehida) dan asetat (asetaldehida) ![]() . Semua zat ini
. Semua zat ini
ketika hadir dalam produk pembakaran hidrokarbon yang tidak sempurna.
Setiap reaksi di mana radikal hidrokarbon terbentuk dapat memulai rantai selama pembakaran hidrokarbon. Ini mungkin reaksi penguraian molekul etana dengan pembentukan dua gugus metil bebas:
![]()
atau reaksi hidrokarbon dengan oksigen:
![]()
Kelanjutan rantai terjadi sebagai akibat dari reaksi pembentukan | peroksida atau hidroperoksida:
![]()
Percabangan rantai terjadi selama penguraian hidroperoksida:
Bab 2. Proses kimia selama pembakaran
Urutan reaksi di atas menyebabkan peningkatan bertahap dalam konsentrasi senyawa peroksida dalam sistem reaksi.
Bersamaan dengan akumulasi peroksida, radikal dan
reaksi paralel mungkin terjadi:
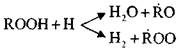
Reaksi-reaksi ini bersifat eksotermik; Ketika hal itu terjadi, sejumlah besar panas dilepaskan.
Dengan meningkatnya suhu campuran yang bereaksi, peran pusat aktif berpindah dari satu produk antara ke produk antara lainnya dengan urutan sebagai berikut: alkil hidroperoksida, asil hidroperoksida, formaldehida.
Studi eksperimental terhadap perubahan komposisi campuran reaksi dari waktu ke waktu di wilayah suhu tinggi (600-800°C) menunjukkan bahwa proses pengubahan hidrokarbon awal menjadi produk pembakaran akhir dibagi menjadi dua tahap: tahap pertama, yang terjadi pada kecepatan yang sangat tinggi, terjadi oksidasi hidrokarbon menjadi CO. Pada tahap kedua, tahap lambat, CO dioksidasi menjadi . Hal ini membawa pada kesimpulan yang sangat penting: banyak pola pembakaran hidrokarbon yang dapat dijelaskan oleh karakteristik pembakaran karbon monoksida.
2.5. Pembakaran karbon
Pembakaran karbon berlangsung melalui mekanisme proses heterogen, yang kekhususannya adalah bahwa tahap kimia tidak dapat dianggap terpisah dari proses perpindahan gas pengoksidasi (oksigen udara) dari ruang sekitarnya ke permukaan padatan yang terbakar. Kecepatan pembakaran ternyata bergantung pada keduanya sifat kimia karbon, dan karakteristik yang menentukan proses suplai oksigen ke permukaan bahan bakar. Pasokan oksigen ke zona pembakaran terjadi melalui difusi dan karenanya
Korolchenko A.Ya. Proses pembakaran dan ledakan
tergantung pada banyak faktor: bentuk dan ukuran benda yang terbakar, pergerakan media gas, koefisien difusi oksigen dan produk reaksi baik di ruang di atas permukaan bahan bakar maupun di celah dan pori-pori yang terkandung dalam batubara dan kokas di jumlah yang signifikan.
Untuk mengilustrasikan ciri-ciri pembakaran karbon yang heterogen, mari kita perhatikan perilaku sepotong batubara yang ditempatkan dalam tungku yang dipanaskan hingga suhu 900°C. Pada saat awal, pembakaran batu bara akan terjadi karena adanya oksigen yang terletak di dekat permukaannya. Setelah dikonsumsi, lapisan produk pembakaran terbentuk di sekitar permukaan yang dipanaskan -. Laju pembakaran akan menurun, dan prosesnya bisa terhenti jika tidak ada pasokan oksigen dari area ruang gas yang lebih jauh.
Pasokan ini terjadi melalui difusi, dan laju pembakaran akan ditentukan oleh besarnya fluks difusi. Intensitas difusi sangat bergantung pada intensitas dan sifat pergerakan media gas di dekat permukaan pembakaran. Laju reaksi kimia ditentukan terutama oleh suhu. Reaksi heterogen, seperti halnya reaksi homogen, mematuhi hukum Arrhenius.
Pada suhu tinggi, reaksi oksidasi karbon berlangsung sangat cepat, dan laju total proses akan dibatasi oleh difusi oksigen ke permukaan.
Dengan demikian, proses pembakaran karbon terdiri dari dua proses yang berbeda sifatnya: proses perpindahan oksigen udara dari ruang gas ke tempat konsumsinya dan proses interaksi kimianya dengan permukaan karbon padat. Kedua proses ini saling berhubungan, namun masing-masing mempunyai pola tersendiri. Proses terpenting dari proses ini adalah proses konsumsi oksigen, yang ditandai dengan berbagai reaksi kimia.
Mekanisme reaksi kompleks penggabungan oksigen dengan karbon adalah pembentukan dua oksida CO dan CO 2 secara simultan melalui kompleks fisikokimia perantara berbentuk C X 0 Y, yang kemudian terurai menjadi CO dan. Perbandingan antara oksida-oksida ini bergantung pada kondisi pembakaran. Dengan demikian, persamaan reaksi pembakaran karbon dapat dituliskan sebagai berikut:
Bab 2. Proses kimia selama pembakaran
Kemudian terjadi reaksi pembakaran karbon monoksida yang homogen:
mekanismenya dibahas pada bagian 2.3.
Reaksi ini dapat terjadi di dekat permukaan karbon, Jadi dan di dalam massa batubara, di pori-pori dan retakannya.
Reaksi lainnya adalah reaksi heterogen antara karbon pijar dan karbon dioksida:
![]()
Hal ini terjadi pada tingkat yang nyata di tempat-tempat yang kekurangan oksigen, namun suhu karbonnya cukup tinggi.
Totalitas reaksi yang dijelaskan menentukan komposisi produk pembakaran karbon.
TERJADINYA PROSES PEMBAKARAN
| G |
Pembakaran dalam campuran yang mudah terbakar dapat terjadi sebagai akibat dari pembakaran spontan, penyalaan oleh sumber luar, atau pembakaran spontan. Jika proses pembakaran dan penyalaan spontan merupakan ciri zat yang berwujud gas, cair atau padat, maka pembakaran spontan merupakan ciri bahan padat (terutama yang dalam keadaan terbagi halus) atau cairan dengan titik didih tinggi yang terdistribusi pada bahan dengan permukaan berkembang. .
3.1. Penyalaan sendiri. Teori stasioner












