Proces spalania. Spalanie jako zjawisko fizyczne. podstawowe terminy i definicje
Niektóre podstawowe definicje
Wygodnie jest wyrazić liczbę atomów i cząsteczek w kategoriach ilość substancji Lub liczba moli substancji. Jeden mol substancji odpowiada 6,023∙10 23 cząstkom (atomom i cząsteczkom). Liczba N A = 6,023 ∙10 23 mol -1 nazywana jest liczbą Avogadro. Ułamek molowy x ja część I reprezentuje stosunek liczby moli n I część I do całkowitej liczby moli n =∑ n I mieszaniny ( x ja = N W).
Waga M jest podstawową właściwością materii (jednostką miary w układzie SI jest kilogram). Ułamek masowy Wi jest stosunkiem masy ja część I do całkowitej masy mieszaniny m = ∑ M ja (Wi = m Jestem).
Masa cząsteczkowa (lub masa cząsteczkowa) M I(g/mol) składnik I jest masą jednego mola danego składnika. Zatem dla węgla atomowego, wodoru cząsteczkowego, tlenu i metanu mamy: M c = 12 g/mol, Mn 2 = 2 g/mol, Mo 2 = 32 g/mol, Mn 4 = 16 g/mol. Średnią masę molową mieszaniny M (g/mol) można wyrazić w ułamkach molowych składników (M = ∑ x i M ja).
Oznaczanie procesów spalania
Spalanie- to skomplikowane proces fizyczno-chemiczny, w którym substancje i materiały łatwopalne pod wpływem wysokich temperatur wchodzą w interakcję chemiczną z czynnikiem utleniającym (tlenem z powietrza), zamieniając się w produkty spalania, czemu towarzyszy intensywne wydzielanie ciepła i promieniowanie świetlne.
Warunki niezbędne do zajścia procesu spalania:
Obecność substancji łatwopalnej (G.V.);
Obecność środka utleniającego (O.) - tlenu w powietrzu;
Dostępność źródła zapłonu (I.S.).
Substancję palną należy podgrzać do określonej temperatury, w której rozpocznie się proces utleniania;
Aby ogrzać substancję łatwopalną do określonej temperatury, wymagana jest pewna moc źródła zapłonu;
Aby wesprzeć proces spalania, wymagane są określone stężenia paliwa i utleniacza.
Najważniejsze procesy podczas spalania - wymiana ciepła i masy. Bardzo własność ogólna spalanie to pojawienie się płomienia i jego ruch w całej palnej mieszaninie poprzez wymianę ciepła lub dyfuzję cząstek aktywnych ze strefy spalania do świeżej mieszaniny palnej.
Płomień jest widocznym przejawem spalania. Nazywa się ją także strefą spalania. Jest to część przestrzeni, w której następuje przemiana mieszaniny palnej w produkty całkowitego i niepełnego spalania.
Głównymi parametrami procesu spalania prowadzącymi do śmierci i szkód materialnych są:
Duża ilość ciepło;
Toksyczny skład produktów spalania.
Proces spalania z punktu widzenia molekularnej teorii kinetyki gazów
Ryż. 2.1. Proporcja cząsteczek aktywnych w zależności od temperatury: T 2 > T 1
Po podgrzaniu mieszaniny palnej gazu wzrasta w niej nadmiar energii.
Różnica pomiędzy średnim poziomem rezerwy energii cząsteczek w stanie aktywnym i średnim poziomem w stanie nieaktywnym nazywana jest energią aktywacji. Można to przedstawić graficznie (ryc. 2).

Ryż. 2.2. Wykres energetyczny postępu reakcji G.V. + O. ® P.G.: Akt E – energia aktywacji; Q х.р – efekt cieplny reakcji spalania
Energia uwolniona w wyniku oddziaływania „pierwszych” przereagowanych cząsteczek jest przekazywana sąsiednim cząsteczkom. Są podekscytowani, proces powtarza się wokół reagujących cząsteczek z dużą częstotliwością i intensywnością. Rozpoczyna się samopodtrzymujący, samoprzyspieszający proces interakcji chemicznej dla całej mieszaniny reakcyjnej (2H 2 + O 2), któremu towarzyszy tworzenie się cząsteczek wody i uwalnianie środowisko ciepło i towarzyszy mu blask, tj. Proces spalania zachodzi i rozprzestrzenia się.
Im wyższa wartość liczbowa aktu E, tym trudniej jest zmusić daną parę składników do wejścia w oddziaływanie chemiczne. Dlatego wartość Eact jest pośrednim wskaźnikiem stopnia niebezpieczeństwo pożaru tego układu chemicznego.
Rodzaje i sposoby spalania
Spalanie można sklasyfikować według następujących parametrów:
1. Zgodnie z warunkiem tworzenia mieszaniny składników palnych:
a) kinetyczny - spalanie wstępnie zmieszanych mieszanin gazu lub pary i powietrza. Ponieważ mieszanina paliwa i utleniacza jest gotowa do spalenia, zanim nastąpi zapłon, całkowita szybkość procesu spalania zależy tylko od prędkości reakcja chemiczna spalanie. Jeżeli takie spalanie nastąpi w zamkniętej lub ograniczonej objętości, może nastąpić eksplozja. Ponieważ energia uwolniona podczas spalania mieszaniny nie ma czasu na usunięcie poza podaną objętość, ze względu na wzrost ciśnienia możliwe jest zniszczenie konstrukcji;
b) dyfuzja, spalanie dyfuzyjne to spalanie podczas formowania łatwopalne środowisko(mieszanie paliwa i utleniacza) następuje przed strefą spalania lub w strefie spalania.
2. W zależności od intensywności dopływu składników palnych do strefy reakcji chemicznej:
a) laminarny, w którym składniki palnej mieszaniny stosunkowo spokojnie wchodzą do strefy spalania. W tym przypadku wartość liczbowa kryterium Reynoldsa charakteryzującego reżim termodynamiczny będzie znacznie mniejsza niż wartość krytyczna (Re<2300).
b) turbulentny, w którym składniki mieszanki palnej z dużą prędkością wchodzą do strefy spalania. Liczba Reynoldsa w tym przypadku jest większa niż 2300.
3. Według stanu skupienia składników mieszaniny palnej:
a) jednorodny – paliwo i utleniacz są w tym samym stanie skupienia (gazowe);
b) heterogeniczny (różne fazy) – paliwo i utleniacz znajdują się w różnych stanach skupienia.
4. W zależności od prędkości propagacji strefy reakcji spalania chemicznego:
a) deflagracja (powolna) propagacja strefy reakcji chemicznej (prędkość od 0,5 do 50 m/s);
b) detonacja (wybuchowa), gdy strefa reakcji spalania chemicznego rozprzestrzenia się z prędkością fali uderzeniowej (od kilkuset metrów na sekundę do kilku kilometrów na sekundę).
Przestrzeń, w której spalają się pary lub gazy, nazywa się płomień .
Płomienie laminarne wstępnie wymieszanej mieszanki. W płomieniach laminarnych z premiksem paliwo i utleniacz mieszają się przed rozpoczęciem spalania, a przepływ jest laminarny.
Nazywa się płomień wstępnie zmieszanej mieszaniny stechiometryczny , jeśli paliwo (węglowodór) i utleniacz (tlen - O 2) zużywają się całkowicie, tworząc dwutlenek węgla (CO 2) i wodę (H 2 O). Jeśli jest nadmiar paliwa, mówi się, że mieszanka jest bogata, a jeśli jest nadmiar utleniacza, mówi się, że mieszanka jest uboga.
Spójrzmy na najprostsze przykłady:
1) 2H 2 + O 2 → 2H 2 O - mieszanina stechiometryczna,
2) ZH 2 + O 2 → 2H 2 O + H 2 - mieszanina bogata (w nadmiarze H 2),
3) CH 4 + ZO 2 → 2H 2 O + CO 2 + O 2 - mieszanka uboga (w nadmiarze O 2).
Każdy symbol w takim równaniu reakcji chemicznej odpowiada jednemu molowi substancji. Zatem pierwsze z tych równań oznacza, że dwa mole H2 reagują z jednym molem O2, tworząc dwa mole H2O.
Jeżeli równanie reakcji chemicznej zapisuje się w taki sposób, że opisuje reakcję dokładnie jednego mola paliwa, to udział molowy paliwa w mieszaninie stechiometrycznej można łatwo wyznaczyć z zależności
x góry,stoch = 1/ ((1+v)
Tutaj w oznacza liczbę moli O 2 w równaniu reakcji z utworzeniem CO 2 i H 2 O. Przykładem jest reakcja
H 2 +0,5O 2 →H 2 O, v=0,5, x H 2,stoich = 2/3
Jeżeli utleniaczem jest powietrze, należy wziąć pod uwagę, że suche powietrze zawiera tylko 21% tlenu, a także 78% azotu i 1% gazów szlachetnych. Zatem dla powietrza X N 2 = 3,762 X O 2. Stąd ułamki molowe dla mieszaniny stechiometrycznej z powietrzem będą równe
x góry,stoch = 1/ ((1+v∙4,762), ![]() ,
,
Gdzie w jak poprzednio, oznacza liczbę moli O 2 w równaniu reakcji całkowitej konwersji jednego mola paliwa na CO 2 i H 2 O. Szereg przykładowych wartości w i ułamki molowe paliwa dla stechiometrycznych mieszanin paliwa z powietrzem podano w tabeli 1.
Mieszanki paliwowo-powietrzne (w tym przypadku do równania reakcji należy dodać odpowiednią ilość N 2, patrz tabela 1) charakteryzują się wartością stosunku zastępczego dla powietrza:
λ = (x samochód /x góry) / (x samochód,stokh / x góry,stokh) = (w wozie /w górach) / (w samochodzie,stokh / w górach,stokh)
lub wartość odwrotna - stosunek równoważny do paliwa F (F= 1/λ). Wzór ten można przekształcić tak, aby wartości ułamków molowych mieszaniny można było określić na podstawie wartości F:
x góry = 1/ ((1+(4,762∙v) / F), x samochód = 1 – x góry,
X wózek / 4,762, = ∙3,762
Przykłady wartości v i ułamków molowych paliwa X góry, stechiometryczna mieszanina paliwa z powietrzem
Spaleniu zawsze towarzyszą przemiany chemiczne. Spalanie w powietrzu to interakcja substancji palnej z tlenem. Należy jednak pamiętać, że tlenki azotu, halogeny i ozon mogą działać jako utleniacze w procesie spalania. Znane są procesy spalania, które zachodzą z udziałem tylko jednego produktu początkowego – związku zdolnego do szybkiego rozkładu. Przykładami takich związków są acetylen i hydrazyna.
Procesy chemiczne zachodzące podczas spalania są niezwykle złożone. Nawet w najprostszym przypadku - spalaniu wodoru w tlenie, którego uogólnione równanie ma postać
2H 2 + 0 2 = 2H 2 0,
Ustalono i zbadano kilkadziesiąt etapów elementarnych.
Dotychczas dostatecznie szczegółowo zbadano mechanizmy przemian chemicznych podczas spalania zaledwie kilku substancji: wodoru, tlenku węgla, metanu i etanu. Wiedzę tę wykorzystuje się do przewidywania warunków zapłonu i spalania wielu substancji.
2.1. Reakcje łańcuchowe
Reakcje łańcuchowe w odróżnieniu od zwykłych przemian chemicznych charakteryzują się pojawieniem się w każdym akcie elementarnym aktywnej cząstki: atomu z niesparowanym elektronem, wolnym rodnikiem lub jonem. Pojawienie się cząstek aktywnych powoduje łańcuch przemian substancji wyjściowych w produkty reakcji. Atomy, wolne rodniki i jony są bardziej reaktywne niż cząsteczki nasycone wartościowością. Dlatego pomimo znacznych kosztów energii potrzebnej do rozerwania wiązań chemicznych i utworzenia cząstek aktywnych, rozwój łańcucha reakcji często okazuje się energetycznie korzystniejszy niż bezpośrednie oddziaływanie między cząsteczkami.
Procesy spalania zachodzą głównie poprzez mechanizm łańcuchowy. Reakcje łańcuchowe to złożone reakcje przebiegające w kilku etapach, którymi są:
Zarodkowanie łańcuchów (inicjacja), w których powstają cząstki aktywne;
Kontynuacja łańcuchów, w których cząsteczki aktywne wchodzą w interakcję chemiczną z substancjami pierwotnymi, w wyniku czego powstają nowe cząsteczki aktywne;
Zakończenie łańcucha, w którym następuje „śmierć” cząstek aktywnych wraz z utworzeniem końcowych produktów reakcji
Zarodkowanie łańcuchów może zachodzić w różnych warunkach. Na przykład w wyniku dysocjacji cząsteczek pod wpływem energii cieplnej lub promieniowania jonizującego w wyładowaniu elektrycznym. Śmierć cząstek aktywnych następuje podczas ich rekombinacji*, podczas oddziaływania wolnych rodników (jednorodne zakończenie łańcucha), podczas oddziaływania cząstek aktywnych z powierzchniami stałymi (heterogeniczne zakończenie łańcucha) lub w wyniku ich reakcji z inhibitorami spalania.
Wyróżnia się reakcje łańcuchowe nierozgałęzione i rozgałęzione. W nierozgałęzionych na każdą cząstkę aktywną zużywaną w reakcjach kontynuacji łańcucha przypada jedna nowo powstająca. Liczba cząsteczek produktu utworzonych na początkową cząstkę aktywną nazywana jest długością łańcucha. Długość łańcuchów w reakcjach spalania waha się od setek tysięcy do dziesiątków milionów. Na szybkość nierozgałęzionych reakcji łańcuchowych mogą mieć wpływ drobne zanieczyszczenia substancjami, które mogą skutecznie oddziaływać z cząsteczkami aktywnymi – inhibitorami spalania.
Niektóre substancje - inicjatory - ułatwiają tworzenie cząstek aktywnych i tym samym przyspieszają reakcje nierozgałęzione.
W rozgałęzionych reakcjach łańcuchowych jedna aktywna cząstka, która jest zużywana w miarę kontynuowania łańcucha, wytwarza dwie lub więcej aktywnych cząstek. Jeden z nich kontynuuje łańcuch pierwotny, podczas gdy inne rozpoczynają nowe łańcuchy, tworząc gałęzie (ryc. 2.1).
„Rekombinacja to proces tworzenia obojętnych atomów lub cząsteczek z naładowanych cząstek. Atomy i cząsteczki powstałe podczas rekombinacji mogą znajdować się w stanie podstawowym lub wzbudzonym.
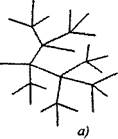
Ryż. 2.1. Schematyczne przedstawienie łańcuchów reakcji:
a) rozgałęzienie w każdym ogniwie łańcucha
6) rzadkie rozgałęzienia
Na przykład podczas spalania wodoru w reakcji zarodkowania łańcucha:
powstaje aktywny atom. W reakcji kontynuacji łańcucha:
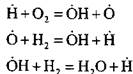
następuje wzrost liczby aktywnych atomów, które są początkiem nowych łańcuchów.
Rozgałęzione reakcje łańcuchowe mogą zachodzić w trybie stacjonarnym, w którym szybkość rozgałęziania jest mniejsza niż szybkość śmierci cząstek aktywnych, oraz w trybie niestacjonarnym, w którym śmierć następuje wolniej niż rozgałęzianie. W tym drugim przypadku szybkość reakcji łańcuchowej rośnie wykładniczo i jest ograniczona jedynie zużyciem substancji wyjściowych. Przejście z trybu stacjonarnego do niestacjonarnego następuje gwałtownie przy niewielkiej zmianie warunków reakcji: temperatury, ciśnienia lub stężenia jednego z reagentów. Takie gwałtowne przyspieszenie uważa się za samozapłon mieszaniny reakcyjnej lub eksplozję łańcucha.
Odkrycie rozgałęzionych reakcji łańcuchowych miało ogromne znaczenie dla powstania teorii procesów spalania. Udowodniono, że istnieją dwa rodzaje zapłonu: termiczny i łańcuchowy. Wzory ustalone w
Rozdział 2. Procesy chemiczne podczas palenie
teorie procesów łańcuchowych, pozwalają skutecznie wpływać na rozwój i tłumienie procesów spalania podczas pożarów.
Pochodzenie łańcuchów. Dużą rolę w rozwoju nierozgałęzionych reakcji łańcuchowych odgrywa proces zarodkowania początkowych centrów aktywnych. Kompensuje utratę aktywnych centrów podczas reakcji zakończenia łańcucha. Mechanizm ten determinuje warunki powstawania reżimu stacjonarnego w początkowym okresie akumulacji ośrodków aktywnych. Przy niskim wskaźniku inicjacji okres ten może być znaczący.
Większość reakcji chemicznych zachodzących w płomieniach charakteryzuje się znaczną rezerwą energii centrów aktywnych. W tych warunkach inicjacja ośrodków aktywnych wiąże się z pokonaniem znacznej bariery energetycznej.
W tym przypadku ważną rolę odgrywają czynniki zapewniające znaczną szybkość tworzenia się centrów aktywnych: dodatki aktywne chemicznie, promieniowanie, wyładowania elektryczne, produkty rozpadu promieniotwórczego.
Wśród czynników znacząco ułatwiających powstawanie ośrodków aktywnych należy zwrócić uwagę na reakcje heterogeniczne. W cząsteczkach substancji palnych zaadsorbowanych na powierzchni stałej wiązania międzyatomowe ulegają osłabieniu i do ich rozerwania potrzeba mniej energii. W tych warunkach tempo generowania centrów aktywnych jest znacznie wyższe niż w objętości gazu. Energia aktywacji podczas heterogenicznego oddziaływania składników mieszaniny palnej jest również niższa niż podczas oddziaływania jednorodnego. Heterogeniczna inicjacja centrów aktywnych w warunkach rzeczywistych procesów spalania jest ważnym czynnikiem przyspieszającym osiągnięcie reżimu stacjonarnego w procesach o łańcuchu nierozgałęzionym.
Pewne cechy charakteryzują nierozgałęzione reakcje łańcuchowe zachodzące z udziałem składników atomowych. W przypadku braku zanieczyszczeń oddziałujących z centrami aktywnymi bez regeneracji, zakończenie łańcucha staje się możliwe jedynie poprzez rekombinację atomów poprzez potrójne zderzenia i na powierzchni.
W dowolnej temperaturze wszystkie substancje gazowe ulegają częściowej dysocjacji. Niektóre cząsteczki rozkładają się na atomy. W tym przypadku istnieje równowaga pomiędzy procesami dysocjacji i łączenia atomów w cząsteczki. Stopień dysocjacji zależy wykładniczo od temperatury.
Jeżeli w mieszaninie palnej nie ma zanieczyszczeń kończących łańcuch, wówczas stężenie atomowych składników reakcji praktycznie się nie zmienia. Atomy biorące udział w reakcji są natychmiast regenerowane w tym samym
Korolchenko A.Ya. Procesy spalania i wybuchu
osobowość. Początkowa inicjacja kompensuje przereagowane atomy w tej samej liczbie, co w układzie niereagującym. Reakcja stacjonarna nie ma wpływu na ten proces. Cechą charakterystyczną tego reżimu jest równowaga jednego ze składników reakcji, charakteryzująca się najsłabszym wiązaniem pomiędzy atomami w cząsteczce. Stężenie drugiego składnika atomowego jest quasi-stacjonarne, ale większe niż równowagowe.
Przy jednorodnym rozpoczęciu reakcji spalania reżim stacjonarny zostanie ustalony dopiero po pewnym czasie, ponieważ dysocjacja wymaga dużej energii aktywacji. W tym okresie szybkość dysocjacji przewyższa szybkość rekombinacji, a w reagującym układzie gromadzą się centra aktywne. Szybkości obu procesów porównuje się dopiero po doprowadzeniu stężenia centrów aktywnych do stanu równowagi. Ten okres nazywa się okresem indukcyjnym.
Obecność stałej powierzchni jako katalizatora w strefie reakcji nie zmienia stanu równowagi termodynamicznej. Katalizator w równym stopniu wpływa na reakcje do przodu i do tyłu. Centra aktywne nie tylko zarodkują na stałej powierzchni, ale także na niej kończą. Jednakże obecność katalizatora przyspiesza osiągnięcie stanu równowagi dysocjacji.
Jeśli mieszanina palna zawiera aktywne zanieczyszczenia, które mogą brać udział w reakcjach zakończenia łańcucha, wówczas zmniejszają one stężenie centrów aktywnych. W takim przypadku równowaga dysocjacji jednego ze składników wyjściowych zostaje zakłócona, co spowalnia reakcję i może prowadzić do jej zakończenia.
Eksperymenty pokazują, że gdy nierozgałęziona reakcja łańcuchowa jest inicjowana przez źródło zewnętrzne (na przykład źródło światła), stężenie centrów aktywnych w początkowej fazie rozwoju procesu spalania może znacznie przekroczyć stężenie równowagowe.
W przypadku wystąpienia reakcji o rozgałęzionym łańcuchu, istotny wpływ na przebieg reakcji mają warunki początkowej inicjacji. W procesach wolno rozwijających się dodanie częściowo przereagowanej mieszaniny do pierwotnej skraca okres indukcji i przyspiesza moment rozpoczęcia spalania płomieniowego.
Kontynuacja łańcuchów. Cechą charakterystyczną nierozgałęzionych reakcji łańcuchowych jest quasi-stacjonarny charakter koncentracji centrów aktywnych. W przypadku braku zakończenia łańcucha powstają aktywne cząstki
Rozdział 2. Procesy chemiczne podczas spalania
w tej samej ilości, w jakiej są spożywane. Nowe powstają dopiero podczas początkowej inicjacji. Gdy szybkości wytwarzania centrów aktywnych i zakończenia łańcucha są równe, ustala się stałe stężenie centrów aktywnych i stacjonarny tryb reakcji. Szybkość reakcji będzie spadać w miarę zużywania się składników wyjściowych.
W przypadku rozgałęzionej reakcji łańcuchowej stężenie centrów aktywnych w reagującym układzie wzrasta niezależnie od warunków ich początkowej inicjacji. Realizowany jest tryb reakcji samoprzyspieszającej, który ma charakter lawinowy. W tym przypadku do całkowitego przekształcenia składników wyjściowych w końcowe produkty reakcji wystarczy jedno początkowe centrum aktywne.
Równanie kinetyczne rozgałęzionej cennej reakcji jest następujące. Zmiany stężeń stabilnych składników wyjściowych w czasie można w pierwszym przybliżeniu pominąć, a uwzględnić jedynie szybsze zmiany stężenia centrów aktywnych P. Zmiany tej szybkości zależą od szybkości początkowej inicjacji i stosunku szybkości reakcji rozgałęziania i kończenia łańcucha. Szybkość początkowej inicjacji nie zależy od stężenia aktywnych centrów obecnych w układzie. Szybkość procesów rozgałęziania i kończenia jest proporcjonalna do stężeń centrów aktywnych. W tych warunkach ogólny bilans tworzenia i zużycia aktywnych ośrodków jest określony przez sumę szybkości procesów inicjowania, rozgałęziania i kończenia:
![]() (2.1)
(2.1)
gdzie i są stałymi szybkości reakcji rozgałęziania i kończenia. Oznaczając , otrzymujemy:
![]() (2.2)
(2.2)
Gdy pochodna czasowa stężenia aktywnych ośrodków
pozytywny. W tym przypadku szybkość reakcji wzrasta z czasem. Ta cecha rozgałęzionych reakcji łańcuchowych wynika z namnażania się centrów aktywnych w takich reżimach, gdy szybkość reakcji rozgałęziania przekracza szybkość reakcji zakończenia łańcucha.
Korolchenko A.Ya. Procesy spalania i wybuchu
Jeżeli przed rozpoczęciem reakcji układ nie zawierał aktywnych centrów, tj. NaT= 0, n = 0 Całkowanie równania (2.2) daje:
![]() (2.3)
(2.3)
Całkowita szybkość reakcji CO zależy od szybkości procesu rozgałęziania. Produkty końcowe powstają dopiero podczas tej reakcji. Dla każdego elementarnego aktu rozgałęzienia łańcucha powstają cząsteczki produktu końcowego. Z tego wynika:
![]() (2.4)
(2.4)
Rozwój reakcji łańcuchowej w czasie jest określony przez stosunek stałych szybkości reakcji rozgałęziania i zakończenia łańcucha oraz At tj. gdy wykładnik w równaniu (2.4) jest dodatni i re-
akcja przyspiesza w nieskończoność. W początkowym okresie rozwoju reakcji obowiązuje następujący stosunek:
Ze względu na niski stopień inicjacji początkowej, w okresie początkowym nie następuje zauważalna przemiana chemiczna. Po pewnym czasie wartość staje się znacznie większa od jedności. Następnie szybkość reakcji, zgodnie z równaniem (2.4), zaczyna szybko rosnąć i osiąga bardzo duże wartości, chociaż wcześniej była praktycznie niezauważalna.
Obecność okresu opóźnienia (okresu indukcji) podczas rozwoju reakcji łańcuchowej wynika z konieczności zgromadzenia określonej liczby centrów aktywnych w układzie reagującym. Dopiero wtedy zauważalna staje się przemiana chemiczna.
Wielkość okresu indukcji w reakcjach łańcuchowych zależy od stosunku szybkości procesów rozgałęziania i kończenia łańcucha, a nie od szybkości początkowej inicjacji. Z kolei szybkości reakcji rozgałęziania i kończenia są określone przez właściwości chemiczne każdego układu reagującego i są określone przez zależności od temperatury i stężeń składników wyjściowych. Osobliwością reakcji łańcuchowych jest
Kluczem jest to, że procesy rozgałęziania wymagają znacznej energii aktywacji, podczas gdy współczynnik temperaturowy stałej szybkości procesu zakończenia jest bliski zeru. Dla reakcji zakończenia łańcucha wszystkich trzech typów: podczas rekombinacji masowej i heterogenicznej, podczas oddziaływania rodników z aktywnymi zanieczyszczeniami, energie aktywacji są równe zeru.
Wraz ze wzrostem temperatury, całkowitego ciśnienia mieszaniny lub zmianą stężenia reagujących składników możliwa jest taka zmiana stałych szybkości rozgałęziania i zakończenia, przy której reakcja przechodzi z trybu stacjonarnego do nie- stacjonarny. Specyfika tego procesu polega na gwałtownym przejściu z jednego trybu do drugiego, na zmianie szybkości reakcji z wartości pomijalnie małej na wartość nieograniczoną.
Występowaniu niektórych reakcji łańcuchowych towarzyszy powstawanie produktów pośrednich, które są stosunkowo trwałe, ale jednocześnie mają zdolność generowania centrów aktywnych. Do takich reakcji zaliczają się np. reakcje spalania węglowodorów, podczas których jako produkty pośrednie powstają nadtlenki i aldehydy. Prowadzi to do rozgałęzień łańcuchowych. Jednakże, ze względu na względną stabilność produktów pośrednich, przyspieszenie reakcji wydłuża się w czasie. Takie powolne rozgałęzianie łańcuchów nazywa się zdegenerowanym.
Reakcje łańcuchowe ze zwykłym mechanizmem rozgałęziania rodnikowego z reguły przebiegają dość szybko ze względu na wysoką aktywność rodników. Powstałe rodniki albo inicjują szybko przyspieszającą reakcję, albo łączą się ponownie i opuszczają proces.
Uszkodzone obwody. Cząstka aktywna, jak każda cząsteczka gazu, podlega chaotycznym ruchom w obrębie reagującego układu, zderzając się z innymi cząsteczkami. W tym przypadku istnieje pewne prawdopodobieństwo, że podczas zderzenia nastąpi interakcja z inną aktywną cząsteczką lub cząsteczką i powstanie nowej aktywnej cząstki, kontynuującej ścieżkę poprzedniej. Rozwój łańcucha reakcji przypomina ruch Browna cząsteczek obojętnych, chociaż przenoszeniu centrów aktywnych towarzyszy reakcja chemiczna. Na ścieżce rozwoju łańcucha występują naprzemiennie aktywne centra dwóch lub więcej typów.
Korolchenko A.Ya. Procesy spalania i wybuchu
Łańcuch reakcji trwa aż do momentu, w którym cząstka aktywna reaguje bez regeneracji. W takim przypadku następuje tzw. przerwa w obwodzie. Procesy terminacji odgrywają dużą rolę w kinetyce reakcji łańcuchowych. Istnieją dwa możliwe rodzaje reakcji prowadzących do śmierci ośrodków aktywnych:
Jednorodne zakończenie (śmierć w objętości mieszaniny reakcyjnej);
Heterogeniczne przerwanie obwodu (śmierć na stałej powierzchni) Jednorodne przerwanie obwodu jest możliwe w jednym z dwóch procesów:
podczas rekombinacji rodników lub podczas oddziaływania różnych składników aktywnych chemicznie z centrami aktywnymi bez regeneracji tych ostatnich.
Niejednorodne przerwanie obwodu następuje na cząsteczkach sadzy powstających podczas spalania lub na powierzchni materiałów stałych. Zakończenie łańcuchów na powierzchni stałej można uznać za dyfuzję centrów aktywnych z mieszaniny gazów na tę powierzchnię, na której zanikają. Mechanizm rekombinacji na powierzchni stałej polega na tym, że aktywna cząsteczka o zwiększonej reaktywności jest absorbowana* na powierzchni. Rodniki zaadsorbowane w sąsiednich obszarach rekombinują ze sobą, ponieważ nie ma barier energetycznych ani przestrzennych dla tego procesu. Cząsteczki stabilnych związków powstałych w wyniku rekombinacji nie uczestniczą już w rozwoju reakcji łańcuchowej.
Jednak nie każde zderzenie cząstki aktywnej z powierzchnią stałą prowadzi do jej adsorpcji. Może odbijać się od powierzchni. Prawdopodobieństwo adsorpcji centrum aktywnego przez powierzchnię stałą nazywa się współczynnikiem akomodacji. Współczynnik ten jest cechą powinowactwa chemicznego cząsteczki aktywnej i powierzchni. W praktycznie ważnych przypadkach cząstka aktywna po odbiciu od ściany nie oddala się od niej na dużą odległość. Istnieje możliwość kolejnych kolizji ze ścianą do czasu jej osadzenia. Dzięki temu procesowi w pewnych warunkach szybkość reakcji jest praktycznie niezależna od współczynnika akomodacji. Proces przebiega w następujący sposób:
* Sorpcja to absorpcja przez ciało stałe (lub ciecz) substancji znajdującej się w środowisku. Ciało pochłaniające nazywa się sorbentem, wchłoniętym- sorbinian. Rozróżnia się absorpcję przez całą masę sorbentu (absorpcja) i przez warstwę powierzchniową (adsorpcja). Sorpcja spowodowana interakcją chemiczną pomiędzy powierzchnią stałego sorbentu i sorbatu nazywana jest chemisorpcją.
__________________________ Rozdział 2. Procesy chemiczne podczas spalania
czy przy każdej kolizji nastąpi przerwa w obwodzie. Stężenie centrów aktywnych na powierzchni można przyjąć jako równe zeru.
W przypadku braku aktywnych zanieczyszczeń w mieszaninie reakcyjnej, zakończenie łańcucha może nastąpić albo na powierzchniach stałych, albo w sposób jednorodny poprzez rekombinację rodników w masie. W prawdziwych pożarach stosuje się głównie drugi sposób.
Dodatki gazów obojętnych do układu reagującego mają pewien wpływ na kinetykę reakcji łańcuchowych. Obojętne dodatki zwiększają liczbę zderzeń z aktywnymi cząstkami, zwiększają prawdopodobieństwo pęknięcia łańcucha i odpowiednio hamują ogólną reakcję.
Skuteczniejsze hamowanie reakcji łańcuchowych uzyskuje się poprzez wprowadzenie do mieszaniny reakcyjnej chemicznie aktywnych dodatków – inhibitorów. Inhibitory oddziałują z centrami aktywnymi prowadzącymi reakcję, rozrywając łańcuchy. Kinetyka reakcji w hamowanej mieszaninie zależy od warunków konkurencji pomiędzy inhibitorem a głównymi składnikami reakcji podczas interakcji z centrami aktywnymi. Przy dużej skuteczności inhibitora i umiarkowanym tempie wytwarzania nowych centrów aktywnych, nawet niewielkie dodatki inhibitora mogą całkowicie stłumić reakcję łańcuchową.
Procesy hamowania mają ogromne znaczenie w praktyce bezpieczeństwa pożarowego i wybuchowego. Zastosowanie inhibitorów pozwala skutecznie wpływać na procesy spalania.
2.2. Procesy chemiczne podczas spalania wodoru
Oddziaływanie cząsteczki wodoru z cząsteczką tlenu przebiega w sposób złożony, poprzez szereg kolejnych etapów. Obecnie ustalono, że spalanie wodoru odbywa się poprzez mechanizm łańcuchowy, w którym cząstki pełnią rolę centrów aktywnych. Bardzo szczegółowo opisano kolejność i znaczenie elementarnych reakcji spalania wodoru dla różnych warunków powstawania i rozwoju płomieni wodorowych.
Najbardziej szczegółową analizę procesu spalania wodoru w trybie samozapłonu metodami eksperymentalnymi i obliczeniowymi przeprowadził profesor A. N. Baratow. Zaproponował następujący schemat procesu obejmujący czternaście podstawowych reakcji elementarnych:
Korolchenko A.Ya. Procesy spalania i wybuchu
Zarodkowanie centrów aktywnych następuje zgodnie z reakcją
![]()
Kontynuacja łańcuchów poprzez reakcje
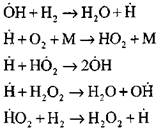
Rozgałęziające się łańcuchy
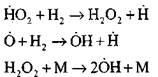 |
przerwane obwody
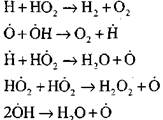 |
Stężenie atomów wodoru w początkowej fazie procesu samozapłonu stanowi niewielką część początkowej zawartości wodoru. W miarę rozwoju reakcji łańcuchowej stopień konwersji wodoru cząsteczkowego staje się tak wysoki, że ulega on zużyciu w ciągu setnych części sekundy.
2.3. Reakcje chemiczne podczas spalania tlenku węgla
Najważniejszą reakcją w procesach spalania jest oddziaływanie tlenku węgla z tlenem. Wystąpienie tej reakcji w
__________________________ Rozdział 2. Proces chemiczny podczas spalania
w wielu przypadkach determinuje sposób spalania substancji zawierających węgiel. Reakcja charakteryzuje się mechanizmem o rozgałęzionym łańcuchu. Różni się wieloma cechami.
Przez długi czas panowało przekonanie, że absolutnie sucha mieszanina CO i 0 2 nie może się zapalić i palić. Jednakże starannie przeprowadzone eksperymenty, podczas których monitorowano brak wody za pomocą spektrografu masowego, wykazały, że zapłon był możliwy również w przypadku suchej mieszaniny. Należy zaznaczyć, że obecność wody lub pary wodoru w układzie CO+02 aktywuje proces zapłonu i spalania poprzez zwiększenie liczby możliwych centrów aktywnych. Przyspieszające działanie wody jest szczególnie zauważalne przy niskich stężeniach.
Spalanie tlenku węgla w obecności pary wodnej lub niewielkich dodatków wodoru następuje przy udziale następujących procesów elementarnych:

Rodniki H0 2 powstałe w reakcji (VI) mogą kontynuować łańcuch (reakcja VIII) lub doprowadzić do jego zakończenia w reakcji (IX-XII).
Aby ocenić warunki przejścia powolnego utleniania CO w eksplozję łańcucha, szacujemy prawdopodobieństwo zakończenia łańcucha przez rodnik H0 2; Jednocześnie bierzemy pod uwagę, że rola reakcji (X) i (XI) w zakończeniu łańcucha będzie niewielka ze względu na
w porównaniu z reakcją (IX), gdyż stałe szybkości procesów (IX-XI) w temperaturach rzędu 1000 K są do siebie zbliżone, ale stężenia rodników są znacznie mniejsze od stężenia atomów wodoru, gdyż rodniki mają większą aktywność chemiczną. Dlatego prawdopodobieństwo zakończenia łańcucha przez rodnik H0 2 można zapisać jako:
W temperaturze 1000K
Dlatego pod warunkiem, że
![]()
![]()
wpływ wielkości
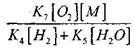
na rozwiązaniu równania (2.7) będzie słabe.
Rozdział 2. Procesy chemiczne podczas spalania
Na wszelki wypadek ![]() Lub
Lub ![]() (co obserwuje się w
(co obserwuje się w
rzeczywiste płomienie CO), równanie (2.7) przekształca się do postaci:
![]() (2.8)
(2.8)
Zatem stan spalania tlenku węgla w powietrzu jest w dużej mierze zdeterminowany obecnością i wzorcem spalania wodoru. Utlenianie CO w reakcji (I) zależy od stężenia rodników OH powstających w reakcjach z udziałem wodoru.
Osobliwością reakcji spalania tlenku węgla jest jego szybkie hamowanie, gdy do układu reagującego wprowadza się małe dodatki substancji o dużym powinowactwie do atomów wodoru. Substancjami hamującymi spalanie CO są halogeny i chlorowcowane pochodne węglowodorów. Ich działanie hamujące wynika z zakończenia łańcuchów reakcji podczas interakcji z atomami wodoru zgodnie z reakcją
2.4. Spalanie węglowodorów
Rozpatrzenie procesów spalania wodoru i tlenku węgla ukazuje złożoność mechanizmu reakcji spalania. W przypadku H 2 i CO reakcja przebiega jako reakcja łańcuchowa z udziałem wielu etapów elementarnych i produktów pośrednich. Naturalnym jest zatem oczekiwanie, że mechanizm reakcji spalania substancji o bardziej złożonej budowie – węglowodorów – jest jeszcze bardziej złożony, a efekty towarzyszące procesom zapłonu i spalania tych związków są bardziej zróżnicowane.
Dostępne obecnie informacje na temat natury nadmiarów chemicznych węglowodorów podczas ich spalania pozwalają w pewnym przybliżeniu wyjaśnić obserwowane efekty.
Ustalono, że w płomieniach węglowodorowych, obok znanych już cząstek aktywnych, występuje duża liczba produktów pośrednich o bardziej złożonej strukturze. W niektórych przypadkach stają się one źródłem powstania nowych łańcuchów. Główną rolę w procesach zapłonu i spalania węglowodorów odgrywają następujące rodzaje związków pośrednich:
Korolchenko A.Ya. Procesy spalania i wybuchu
1. Rodniki węglowodorowe, które są cząsteczką węgla
chlorowodór, z którego usunięto jeden lub więcej atomów wodoru. Te
reszty nazywane są alkilami (CH3 - metyl; C2H5 - etyl; C3H7 - propyl i
itp.). Ze względu na wysoką reaktywność alkili w postaci wolnej
nie istnieją od dawna. Występuje w płomieniach jako półprodukty
nowe produkty. Podczas interakcji z innymi cząsteczkami zachowują się
jako niezależna grupa strukturalna. Rodniki węglowodorowe
zwykle reprezentowana przez literę R.
2. Nadtlenki są związkami o wzorze ogólnym R-00-R.”
3. Aldehydy – związki typu
![]()
Najprostsze aldehydy to mrówkowy (formaldehyd) i octowy (aldehyd octowy). ![]() . Są to wszystkie substancje
. Są to wszystkie substancje
gdy są obecne w produktach niecałkowitego spalania węglowodorów.
Każda reakcja, w wyniku której powstają rodniki węglowodorowe, może zainicjować łańcuch podczas spalania węglowodorów. Może to być reakcja rozkładu cząsteczki etanu z utworzeniem dwóch wolnych grup metylowych:
![]()
lub reakcja węglowodoru z tlenem:
![]()
Kontynuacja łańcuchów następuje w wyniku reakcji tworzenia | nadtlenki lub wodoronadtlenki:
![]()
Rozgałęzienie łańcucha następuje podczas rozkładu wodoronadtlenku:
Rozdział 2. Procesy chemiczne podczas spalania
Zadana sekwencja reakcji prowadzi do stopniowego wzrostu stężenia związków nadtlenkowych w układzie reagującym.
Jednocześnie z akumulacją nadtlenków, rodników i
możliwe są reakcje równoległe:
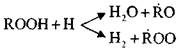
Reakcje te są egzotermiczne; Kiedy one wystąpią, uwalniana jest duża ilość ciepła.
Wraz ze wzrostem temperatury mieszaniny reakcyjnej rola centrów aktywnych przechodzi z jednego produktu pośredniego na drugi w następującej kolejności: wodoronadtlenki alkilu, wodoronadtlenki acylu, formaldehydy.
Z badań eksperymentalnych zmian składu mieszaniny reakcyjnej w czasie w obszarze wysokich temperatur (600-800°C) wynika, że proces przemiany węglowodorów początkowych w końcowe produkty spalania dzieli się na dwa etapy: w pierwszym, który zachodzi przy bardzo dużej prędkości następuje utlenianie węglowodorów do CO. W drugim, powolnym etapie CO utlenia się do . Prowadzi to do bardzo ważnego wniosku: wiele wzorców spalania węglowodorów można wyjaśnić charakterystyką spalania tlenku węgla.
2.5. Spalanie węgla
Spalanie węgla przebiega poprzez mechanizm procesu heterogenicznego, którego specyfika polega na tym, że etapu chemicznego nie można rozpatrywać w oderwaniu od procesu przenoszenia gazowego utleniacza (tlenu z powietrza) z otaczającej przestrzeni na powierzchnię płonącej substancji stałej. Okazuje się, że szybkość spalania zależy zarówno od właściwości chemicznych węgla, jak i od cech decydujących o procesie dostarczania tlenu na powierzchnię paliwa. Dostarczanie tlenu do strefy spalania następuje poprzez dyfuzję, a zatem
Korolchenko A.Ya. Procesy spalania i wybuchu
zależy od wielu czynników: kształtu i wielkości płonącego ciała, ruchu ośrodka gazowego, współczynników dyfuzji tlenu i produktów reakcji zarówno w przestrzeni nad powierzchnią paliwa, jak i w pęknięciach i porach zawartych w węglu i koksie znaczne ilości.
Aby zilustrować cechy heterogenicznego spalania węgla, rozważmy zachowanie się pojedynczego kawałka węgla umieszczonego w piecu nagrzanym do temperatury 900°C. W początkowej chwili spalanie węgla będzie następowało pod wpływem tlenu znajdującego się blisko jego powierzchni. Po jego zużyciu wokół nagrzanej powierzchni tworzy się warstwa produktów spalania. Szybkość spalania spadnie, a proces mógłby się zatrzymać, gdyby nie było dopływu tlenu z bardziej odległych obszarów przestrzeni gazowej.
Zasilanie to następuje poprzez dyfuzję, a szybkość spalania będzie określona przez wielkość strumienia dyfuzyjnego. Intensywność dyfuzji w dużej mierze zależy od intensywności i charakteru ruchu ośrodka gazowego w pobliżu powierzchni spalania. Szybkość reakcji chemicznej zależy głównie od temperatury. Reakcje heterogeniczne, podobnie jak jednorodne, podlegają prawu Arrheniusa.
W wysokich temperaturach reakcja utleniania węgla przebiega bardzo szybko, a całkowita szybkość procesu będzie ograniczona przez dyfuzję tlenu na powierzchnię.
Zatem proces spalania węgla składa się z dwóch procesów o różnym charakterze: procesu przenoszenia tlenu z powietrza z przestrzeni gazowej do miejsca jego zużycia oraz procesu jego chemicznego oddziaływania z powierzchnią stałego węgla. Oba te procesy są ze sobą powiązane, ale każdy ma swoje własne wzorce. Najważniejszym z tych procesów jest proces zużycia tlenu, który charakteryzuje się różnorodnymi reakcjami chemicznymi.
Mechanizm złożonej reakcji łączenia tlenu z węglem polega na jednoczesnym tworzeniu dwóch tlenków CO i CO 2 poprzez pośredni kompleks fizykochemiczny w postaci CX 0 Y, który następnie rozkłada się na CO i. Stosunek tych tlenków zależy od warunków spalania. Odpowiednio równanie reakcji spalania węgla można zapisać w następujący sposób:
Rozdział 2. Procesy chemiczne podczas spalania
Następnie zachodzi jednorodna reakcja spalania tlenku węgla:
którego mechanizm omówiono w rozdziale 2.3.
Reakcja ta może zachodzić w pobliżu powierzchni węgla, Więc oraz wewnątrz masy węglowej, w jej porach i pęknięciach.
Inną reakcją jest heterogeniczna reakcja pomiędzy żarzącym się węglem i dwutlenkiem węgla:
![]()
Występuje w zauważalnym tempie tam, gdzie brakuje tlenu, ale gdzie temperatura węgla jest dość wysoka.
Całość opisanych reakcji określa skład produktów spalania węgla.
WYSTĘPOWANIE PROCESÓW SPALANIA
| G |
Zapalenie mieszanin palnych może nastąpić w wyniku ich samozapłonu, zapłonu od źródła zewnętrznego lub samozapłonu. Jeżeli procesy samozapłonu i zapłonu są charakterystyczne dla substancji w stanie gazowym, ciekłym lub stałym, to samozapłon jest charakterystyczny dla materiałów stałych (zwłaszcza w stanie drobno rozdrobnionym) lub wysokowrzących cieczy rozmieszczonych na materiałach o rozwiniętej powierzchni .
3.1. Samozapłon. Teoria stacjonarna
Pożar to niekontrolowany proces spalania, rozwijający się w czasie i przestrzeni, niebezpieczny dla ludzi i powodujący szkody materialne.
Czynnikami pożarowymi niebezpiecznymi dla ludzi są: otwarty ogień, iskry, podwyższona temperatura, toksyczne produkty spalania, dym, obniżona zawartość tlenu oraz zawalenie się budynków lub instalacji.
Spalanie to szybko zachodząca reakcja fizyczna i chemiczna, której towarzyszy wydzielanie ciepła i dymu, pojawienie się płomienia lub tlenie. W normalnych warunkach spalanie to proces utleniania lub łączenia substancji palnej z tlenem z powietrza. Jednakże niektóre substancje (na przykład sprężony acetylen, chlorek azotu, ozon) mogą eksplodować bez tlenu, wytwarzając ciepło i płomień. W związku z tym spalanie może wynikać nie tylko z reakcji łączenia, ale także rozkładu. Wiadomo również, że wodór i wiele metali może palić się w atmosferze chloru, miedzi w parach siarki, magnezu w dwutlenku węgla itp.
Najbardziej niebezpieczne spalanie ma miejsce, gdy substancja palna utlenia się pod wpływem tlenu atmosferycznego. W takim przypadku konieczne jest posiadanie źródła zapłonu zdolnego zapewnić układowi palnemu wymaganą ilość energii. Najczęstszymi źródłami zapłonu są: iskry powstające podczas awarii urządzeń elektrycznych, uderzenia ciał metalowych, spawania, kucia; ciepło powstające w wyniku tarcia; technologiczne urządzenia grzewcze; urządzenia strzelające; ciepło sprężania adiabatycznego; wyładowania iskrowe elektryczności statycznej; przegrzanie styków elektrycznych; reakcje chemiczne zachodzące wraz z wydzielaniem ciepła.
Temperatura ogrzewania tych źródeł jest różna. Zatem iskra powstająca w wyniku uderzenia metalowych ciał może mieć temperaturę do 1900 ° C, płomień zapałki wynosi około. 800°C, bęben napędowy przenośnika taśmowego podczas poślizgu dochodzi do 600°C, a pod wpływem ciepła wyładowania elektrycznego temperatura dochodzi do 10 000°C, a reakcje chemiczne kończą się niemal natychmiast.
Spalanie może być całkowite lub niecałkowite. Przy całkowitym spalaniu zachodzącym w nadmiarze tlenu produktami reakcji są dwutlenek węgla, woda, azot i dwutlenek siarki. Niecałkowite spalanie występuje, gdy brakuje tlenu; produktami spalania w tym przypadku są substancje toksyczne i łatwopalne - tlenek węgla, alkohole, ketony, aldehydy itp. Do całkowitego spalenia substancji palnej wymagana jest pewna ilość powietrza. : 1 kg drewna – 4,18, torf – 5,8, propan – 23,8 m3.
Proces spalania można sobie wyobrazić w następujący sposób. Po wprowadzeniu impulsu termicznego zimne medium palne nagrzewa się, następuje intensywne utlenianie ośrodka palnego tlenem i uwalniane jest dodatkowe ciepło. To z kolei prowadzi do nagrzania sąsiedniej warstwy substancji palnej, w której również zachodzi intensywna reakcja chemiczna. Przy takim spalaniu substancji palnej warstwa po warstwie strefa spalania porusza się; prędkość tego ruchu określa intensywność procesu spalania i jest jego najważniejszą cechą. Proces ogrzewania, utleniania i spalania warstwa po warstwie trwa aż do wyczerpania całej objętości substancji palnej.
Wąska strefa, w której substancja jest podgrzewana i zachodzi reakcja chemiczna, nazywana jest frontem płomienia.
Układy palne mogą być chemicznie jednorodne lub niejednorodne. Układy jednorodne chemicznie to mieszaniny palnych gazów, par lub pyłów z powietrzem, w których substancja palna i powietrze są równomiernie wymieszane. Spalanie takich układów nazywa się jednorodnym. W układach chemicznie niejednorodnych substancja palna i powietrze nie mieszają się i mają granicę międzyfazową. Są to najczęściej stałe materiały palne, a ich spalanie nazywa się heterogenicznym.
Całkowity czas spalania mieszaniny palnej tg składa się z czasu potrzebnego na kontakt substancji palnej z tlenem τ to oraz czasu, w którym zachodzi sama reakcja utleniania chemicznego τ x
W zależności od stosunku tych dwóch terminów, rozróżnia się spalanie dyfuzyjne i kinetyczne. Podczas spalania stałych substancji palnych czas potrzebny na penetrację (dyfuzję) tlenu na powierzchnię substancji jest znacznie dłuższy niż czas reakcji chemicznej, dlatego ogólna szybkość spalania jest całkowicie zdeterminowana szybkością dyfuzji tlenu do substancję palną. Spalanie takich substancji najczęściej zachodzi podczas pożarów i nazywa się dyfuzją. Spalanie, którego szybkość zależy od szybkości reakcji chemicznej, nazywa się kinetycznym. Ten rodzaj spalania jest typowy dla jednorodnych układów palnych.
Wyróżnia się kalorymetryczne, teoretyczne i rzeczywiste temperatury spalania.
Kalorymetryczna temperatura spalania to temperatura, do której nagrzewają się produkty całkowitego spalania, jeśli całe uwolnione ciepło zostanie wydane na ich ogrzanie, ilość powietrza jest równa teoretycznie wymaganej, następuje całkowite spalenie substancji, a temperatura początkowa wynosi 0°C Zakłada się, że straty ciepła są zerowe. Jeżeli początkowa temperatura substancji palnej i powietrza wynosi 0°C, to kalorymetryczna temperatura spalania
![]()
gdzie Qn to dolne ciepło spalania substancji palnej, kcal/kg; V - objętość produktów spalania, m3/kg; с - średnia objętościowa pojemność cieplna produktów spalania, kcal/m3 st.
W związku z tym kalorymetryczna temperatura spalania zależy wyłącznie od właściwości substancji palnej, a nie od jej ilości. Teoretyczna temperatura spalania uwzględnia straty ciepła podczas spalania w wyniku dysocjacji. Kalorymetryczna temperatura spalania jest najwyższą dla substancji palnej i służy do oceny jakościowej. W rzeczywistości podczas spalania zawsze dochodzi do utraty ciepła na skutek promieniowania, nagrzewania nadmiaru powietrza i otoczenia.
Rzeczywista temperatura spalania to temperatura ognia. Rozróżnia się temperaturę pożaru wewnętrznego i zewnętrznego. Temperatura ognia zewnętrznego to temperatura płomienia, a temperatura ognia wewnętrznego to temperatura dymu w pomieszczeniu. Rzeczywiste temperatury powstające podczas pożaru w wyniku utraty ciepła do otoczenia, nagrzewania się produktów spalania i konstrukcji
zawsze mniej niż teoretycznie o 30...50%. Na przykład teoretyczna temperatura spalania benzyny wynosi 1730°C, a rzeczywista temperatura spalania wynosi 1400°C.
Mieszanka łatwopalnych par i gazów z utleniaczem może się palić tylko wtedy, gdy zawiera określoną ilość paliwa.
Najniższe stężenie gazu palnego, przy którym spalanie jest już możliwe, nazywane jest dolną granicą stężenia palnego (LCFL). Najwyższe stężenie, przy którym nadal możliwe jest spalanie, nazywane jest górną granicą palności (UCL). Obszar koncentracji leżący wewnątrz tych granic nazywany jest obszarem zapłonu. Zapłon to zapłon (początek spalania), któremu towarzyszy pojawienie się płomienia. Jest to stabilne, długotrwałe spalanie, które nie ustaje nawet po usunięciu źródła zapłonu. Wartości dolnej i górnej granicy palności zależą od właściwości mieszanin gazów, par i pyłów z powietrzem oraz zawartości składników obojętnych w mieszaninie palnej. Dodanie gazów obojętnych do mieszaniny palnej zawęża obszar zapłonu i ostatecznie czyni ją niepalną. Niektóre zanieczyszczenia spowalniające reakcje spalania znacznie zawężają granice palności. Najbardziej aktywne z nich to węglowodory chlorowcowane. Obie odnotowane właściwości służą do zatrzymania spalania. Obniżenie ciśnienia mieszaniny poniżej atmosferycznego również zawęża obszar zapłonu, a przy pewnym ciśnieniu mieszanina staje się niepalna. Wzrost ciśnienia mieszanki palnej rozszerza obszar zapłonu, ale z reguły nieznacznie. Wzrost temperatury mieszaniny palnej rozszerza obszar zapłonu. Na granice stężenia zapłonu wpływa także moc źródła zapłonu.
Istnieją nie tylko granice stężeń, ale także granice temperatury zapłonu.
Granice temperatury zapłonu par w powietrzu to temperatury substancji palnej, w których jej pary nasycone tworzą stężenia odpowiadające dolnej lub górnej granicy stężenia zapłonu. Temperatura zapłonu to najniższa temperatura, w której substancja zapala się lub zaczyna tlić i pali się lub tli po usunięciu źródła zapłonu. Temperatura zapłonu charakteryzuje zdolność substancji do niezależnego spalania. Jeżeli substancja nie ma temperatury palnej, wówczas klasyfikuje się ją jako trudnopalną lub niepalną.
Przyspieszenie reakcji utleniania pod wpływem temperatury prowadzi do samozapłonu. W przeciwieństwie do procesu spalania, w którym zapala się tylko ograniczona część objętości – powierzchnia – samozapłon następuje w całej objętości substancji. Temperatura samozapłonu to najniższa temperatura, do której należy ogrzać substancję, aby nastąpił jej zapłon w wyniku dalszego samoutleniania. Samozapłon jest możliwy tylko wtedy, gdy ilość ciepła wydzielonego w procesie utleniania przewyższa ilość ciepła oddawanego do otoczenia.
Temperatura samozapłonu substancji nie jest stała, gdyż w dużej mierze zależy od warunków jej oznaczania. W celu uzyskania danych porównawczych ujednolicono sprzęt badawczy i metody określania temperatury samozapłonu gazów i par (GOST 13920-68). Minimalna temperatura określona metodą standardową, do której należy równomiernie ogrzać mieszaninę gazów i par z powietrzem, aby nastąpiła jej zapalenie bez wprowadzania do niej zewnętrznego źródła zapłonu, nazywana jest standardową temperaturą samozapłonu.
Rodzajem samozapłonu jest samozapłon, czyli spalanie w wyniku samonagrzania bez wpływu źródła zapłonu. Różnica między samozapłonem a samozapłonem polega na wielkości temperatury. Samozapłon zachodzi w temperaturze otoczenia, a do samozapłonu konieczne jest podgrzanie substancji z zewnątrz.












