Ugumu wa kaboni ya maji. Uamuzi wa ugumu wa carbonate ya maji
Ufafanuzi ugumu wa carbonate maji. Uhesabuji wa viwango vya ioni za kaboni na bicarbonate. 10 ml ya maji ya kuchambuliwa hutiwa ndani ya chupa na matone 5-6 ya phenolphthalein huongezwa. Ikiwa hakuna rangi inaonekana, basi inachukuliwa kuwa hakuna ions za carbonate katika sampuli. Ikiwa rangi ya waridi itatokea, sampuli ina alama ya 0.05 N. suluhisho asidi hidrokloriki mpaka kubadilika rangi. Mkusanyiko wa ioni za carbonate huhesabiwa kwa kutumia formula, wapi  - mkusanyiko wa ion carbonate, mg/l;
- mkusanyiko wa ion carbonate, mg/l; 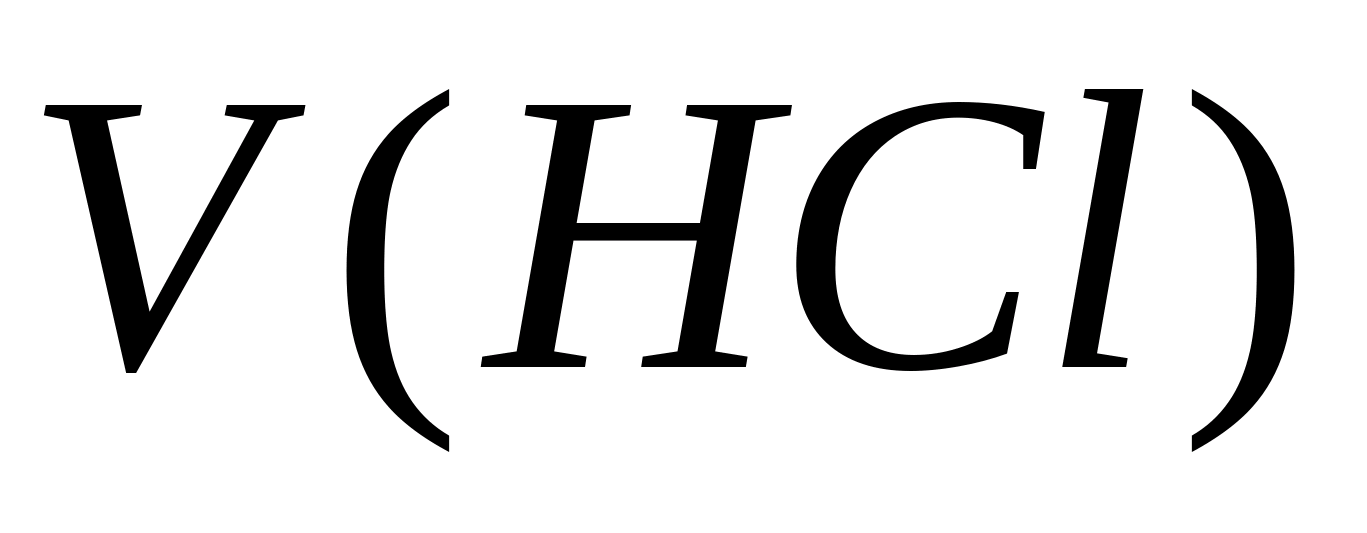 - kiasi cha asidi hidrokloriki inayotumiwa kwa titration, ml. Kisha, katika sampuli sawa, mkusanyiko wa ions ya bicarbonate imedhamiriwa. Ongeza matone 1-2 ya machungwa ya methyl kwenye sampuli. Katika kesi hii, sampuli hupata rangi ya njano. Thibitisha sampuli kwa suluhisho la 0.05 N. asidi hidrokloriki mpaka rangi inageuka njano hadi nyekundu. Mkusanyiko wa ioni za bicarbonate huhesabiwa kwa kutumia formula, wapi
- kiasi cha asidi hidrokloriki inayotumiwa kwa titration, ml. Kisha, katika sampuli sawa, mkusanyiko wa ions ya bicarbonate imedhamiriwa. Ongeza matone 1-2 ya machungwa ya methyl kwenye sampuli. Katika kesi hii, sampuli hupata rangi ya njano. Thibitisha sampuli kwa suluhisho la 0.05 N. asidi hidrokloriki mpaka rangi inageuka njano hadi nyekundu. Mkusanyiko wa ioni za bicarbonate huhesabiwa kwa kutumia formula, wapi  - mkusanyiko wa ion ya bicarbonate, mg / l; - kiasi cha asidi hidrokloriki zinazotumiwa kwa titration, ml. Kiwango cha manufaa ya kisaikolojia ya maji ya kunywa kwa hidrokaboni ni kutoka 30-400 mg / l. Ugumu wa kaboni Fc huhesabiwa kwa muhtasari wa viwango vya mkusanyiko wa ioni za kaboni na bicarbonate kulingana na fomula, ambapo 0.0333 na 0.0164 ni mgawo sawa na upatanisho wa misa sawa ya anions hizi.
- mkusanyiko wa ion ya bicarbonate, mg / l; - kiasi cha asidi hidrokloriki zinazotumiwa kwa titration, ml. Kiwango cha manufaa ya kisaikolojia ya maji ya kunywa kwa hidrokaboni ni kutoka 30-400 mg / l. Ugumu wa kaboni Fc huhesabiwa kwa muhtasari wa viwango vya mkusanyiko wa ioni za kaboni na bicarbonate kulingana na fomula, ambapo 0.0333 na 0.0164 ni mgawo sawa na upatanisho wa misa sawa ya anions hizi.
Njia ya pombe-sabuni.
1.Andaa suluhisho la pombe-sabuni. (futa 0.75 g ya sabuni ya mtoto na 50 ml ya pombe 96% iliyorekebishwa, kuondoka kwa saa 48, chujio. 2. Tayarisha ufumbuzi wa kawaida wa chumvi za kalsiamu na magnesiamu - 0.385
kuyeyusha kloridi ya kalsiamu ya fuwele na maji yaliyoyeyushwa katika chupa ya ujazo ya 50 ml, na kufuta 0.108 g ya sulfate ya magnesiamu ya fuwele katika 30 ml ya maji. Mimina 37.5 ml ya suluhisho la kloridi ya kalsiamu na suluhisho lote la sulfate ya magnesiamu kwenye chupa ya 100 ml ya volumetric, changanya, ongeza maji yaliyotengenezwa kwa alama.
Ugumu wa jumla wa suluhisho la kawaida ni 35 mmol eq / l 3. Titrate maji ya mtihani. Kuamua ugumu.
Uwezo wa kuoksidishwa.
Moja ya viashiria vya moja kwa moja vya ubora wa vitu vya kikaboni vilivyomo kwenye maji
dutu yoyote. Permanganate ya potasiamu kawaida huoksidisha 25-50% ya vitu vya kikaboni vilivyomo ndani ya maji.
Kuamua uoksidishaji, ni muhimu kumwaga 5 ml ya maji (iliyochujwa) kwenye tube ya mtihani, kuongeza 0.3 ml ya suluhisho la asidi ya sulfuriki (1: 3) na 0.5 ml ya suluhisho la 0.01 N la permanganate ya potasiamu. Koroga mchanganyiko na kuondoka kwa dakika 20. Kadiria kiasi cha oxidation. Jedwali 4 Kiashiria cha oksidi
| Uchoraji wa sampuli | Uwezo wa oksidi, mg/l |
| Mkali wa lilac pink | |
| Lilac-pink | |
| Hafifu lilac-pink | |
| Rangi ya lilac ya pinki | |
| Rangi ya waridi | |
| Pink-njano | |
 = RbCrO
= RbCrO  njano Ikiwa uwingu wa suluhisho huzingatiwa, basi mkusanyiko wa cations za risasi ni zaidi ya 20 ml / l, na kwa opalescence - 0.1 mg / l. Utambuzi wa cations za chuma. Vitendanishi: ammoniamu thiocyanate (20 g NH 4 CNS kufutwa katika maji distilled na diluted kwa 100 ml); asidi ya nitriki (conc.); peroxide ya hidrojeni (ω (%) = 5%). Masharti ya majibu 1. pH
njano Ikiwa uwingu wa suluhisho huzingatiwa, basi mkusanyiko wa cations za risasi ni zaidi ya 20 ml / l, na kwa opalescence - 0.1 mg / l. Utambuzi wa cations za chuma. Vitendanishi: ammoniamu thiocyanate (20 g NH 4 CNS kufutwa katika maji distilled na diluted kwa 100 ml); asidi ya nitriki (conc.); peroxide ya hidrojeni (ω (%) = 5%). Masharti ya majibu 1. pH  3.0 2. Joto la chumba. 3. Kwa hatua ya peroxide ya hidrojeni, Fe (II) ions ni oxidized kwa Fe (III). Kufanya Uchambuzi Kwa 10 ml ya sampuli ya maji kuongeza tone 1 la asidi ya nitriki, kisha matone 2 - 3 ya peroxide ya hidrojeni na kuongeza 0.5 ml ya thiacyanate ya ammoniamu. Wakati mkusanyiko wa ions za chuma ni zaidi ya 2.0 mg / l, rangi ya pink inaonekana katika mkusanyiko wa zaidi ya 10 mg / l, rangi hugeuka nyekundu:
3.0 2. Joto la chumba. 3. Kwa hatua ya peroxide ya hidrojeni, Fe (II) ions ni oxidized kwa Fe (III). Kufanya Uchambuzi Kwa 10 ml ya sampuli ya maji kuongeza tone 1 la asidi ya nitriki, kisha matone 2 - 3 ya peroxide ya hidrojeni na kuongeza 0.5 ml ya thiacyanate ya ammoniamu. Wakati mkusanyiko wa ions za chuma ni zaidi ya 2.0 mg / l, rangi ya pink inaonekana katika mkusanyiko wa zaidi ya 10 mg / l, rangi hugeuka nyekundu: Fe 3+ + 3CNS – = Fe(CNS) 3 Nyekundu
Mbinu ya kueleza ya rangi
1. Kugundua chuma (III). Ongeza matone 3 ya thiocyanate ya ammoniamu (au potasiamu) kwa 5 ml ya maji yanayojaribiwa, changanya na kulinganisha rangi ya sampuli na kiwango.
2. Kugundua jumla ya chuma. Kwa 5 ml ya maji ya mtihani kuongeza tone 1 la ufumbuzi wa bromini na matone 3 ya ufumbuzi wa asidi hidrokloriki. Baada ya dakika 5, ongeza matone 3 ya suluhisho la thiocyanate ya ammoniamu (potasiamu), changanya na kulinganisha na kiwango (Jedwali 6).
Jedwali 5 Kiwango cha uamuzi wa chuma
| Chuma mg/l | 0,1 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 | 1,2 | 1,4 | 1,6 | |
| Suluhisho 1 ml | 1,0 | 1,7 | 3,2 | 4,7 | 6,2 | 7,8 | 9,2 | 10,4 | 11,6 | |
| Suluhisho 2 ml | 0,7 | 1,7 | 3,4 | 5,1 | 7,0 | 9,0 | 11,1 | 13,7 | 16,3 | |
| Maji | Hadi 50 ml | |||||||||
Maandalizi ya suluhisho:
thiocyanate ya ammoniamu: 3.8 kufutwa katika 100 ml ya maji yaliyotengenezwa;
· potasiamu hexacyanoferrate (III): 5.5 g kufutwa katika 100 ml ya maji distilled;
· potasiamu hexacyanoferrate (II): 5.25 g kufutwa katika 100 ml ya maji distilled;
ufumbuzi wa bromini: kuongeza 5 g ya KBr hadi 2.5 g ya KBrO3 na kufuta katika 100 ml ya maji distilled;
· suluhisho 1: kwa 2 ml ya suluhisho la 10% ya kloridi ya platinamu, ongeza 10 ml ya asidi hidrokloriki iliyojilimbikizia na kurekebisha 100 ml na maji yaliyotengenezwa;
Suluhisho la 2: 2.5 g ya klorate ya cobalt hupasuka katika 50 ml ya maji yaliyotengenezwa, 10 ml ya asidi hidrokloric iliyojilimbikizia huongezwa na kiasi kinarekebishwa hadi 100 ml.
3. Kugundua chuma (II). Kuamua kwa hesabu - kwa tofauti kati ya maudhui ya jumla ya chuma na chuma (III).
Wakati maudhui ya chuma katika maji ni zaidi ya 1-2 mg / l (oksidi ya feri ni zaidi ya 0.3 mg / l), huanza kutoa maji ladha isiyofaa ya kutuliza nafsi. Misombo ya chuma ya koloidal pia hupa maji rangi ya manjano hadi kijani kibichi. Yanapokabiliwa na oksijeni, maji yenye kiwango cha juu cha chuma huwa na mawingu kutokana na kunyesha kwa chembe gumu za Fe(OH)3. Matumizi ya muda mrefu ya maji na maudhui ya juu ya chuma na mtu yanaweza kusababisha maendeleo ya ugonjwa wa ini - hemosideritis, tukio la athari za mzio, uundaji wa mawe ya figo, na pia huongeza hatari ya magonjwa ya mfumo wa mifupa.
Utambuzi wa kalsiamu
Kwa 10 ml ya sampuli, ongeza matone machache ya 10% ya suluhisho la asidi hidrokloriki na 5 ml ya 4% ya oxalate ya ammoniamu. Mvua nyeupe ya oxalate ya kalsiamu inaonyesha uwepo wa asilimia kadhaa ya kalsiamu. Kwa maudhui ya kalsiamu ya chini (mamia ya asilimia), mawingu kidogo ya suluhisho huzingatiwa. Kiwango cha kalsiamu ni kutoka 25 hadi 130 mg / l.
Utambuzi wa sodiamuUwepo wa sodiamu huhukumiwa na rangi ya njano ya njano ya moto wa burner wakati fimbo ya kioo yenye tone la suluhisho la sampuli imeingizwa ndani yake.
Utambuzi wa shaba
Mkusanyiko wa juu unaoruhusiwa wa shaba katika maji ni 0.1 mg/l, kiashiria cha hatari ya kizuizi cha organoleptic.
Utambuzi wa ubora wa shaba
3-5 ml ya maji ya kupimwa huwekwa kwenye kikombe cha porcelaini, huvukiza kwa uangalifu hadi ukame na tone la ufumbuzi wa amonia uliojilimbikizia hutumiwa kwenye sehemu ya pembeni ya doa. Kuonekana kwa rangi ya bluu kali au violet inaonyesha kuwepo kwa ions za shaba. Utambuzi wa ioni za kloridi.
Mkusanyiko wa kloridi katika hifadhi - vyanzo vya maji vinaruhusiwa hadi 350 mg / l.
Maji ya mito katika sehemu ya kaskazini ya Urusi kawaida huwa na kloridi kidogo, si zaidi ya 10 mg / l, katika mikoa ya kusini - hadi makumi na mamia ya mg / l. Kloridi nyingi huishia kwenye miili ya maji kupitia uvujaji wa kaya na viwandani. maji taka. Kiashiria hiki ni muhimu sana wakati wa kutathmini hali ya usafi wa hifadhi.
Vitendanishi: nitrati ya fedha (5 g AgNO 3 kufutwa katika 95 ml ya maji); asidi ya nitriki (1:4). Masharti ya majibu 1. pH 7.0 2. Joto la chumba. Kufanya Uchambuzi Ongeza matone 3-4 ya asidi ya nitriki kwa 10 ml ya sampuli ya maji na kuongeza 0.5 ml ya suluhisho la nitrate ya fedha. Mvua nyeupe huunda wakati mkusanyiko wa ioni za kloridi ni zaidi ya 100 mg / l: Cl - + Ag + = AgCl nyeupe ya suluhisho huzingatiwa ikiwa mkusanyiko wa ions kloridi ni zaidi ya 10 mg / l, opalescence ni zaidi. zaidi ya 1 mg / l. Jedwali 6 Takriban maudhui ya kloridi kulingana na mashapo au tope.| Sediment au mawingu | Kuzingatia, mg / l |
| Ukungu dhaifu | |
| Ukungu wenye nguvu | |
| Flakes fomu, lakini si kukaa mara moja | |
| Mchanga mweupe wa voluminous |
Jedwali 7 Maudhui ya takriban ya ioni za sulfate kulingana na mchanga au tope.
| Tabia ya sediment | Kuzingatia, mg / l |
| Hakuna ukungu | |
| Uwingu mdogo ambao hauonekani mara moja, lakini baada ya dakika chache. | |
| Uwingu kidogo huonekana mara baada ya kuongeza kloridi ya bariamu | |
| Nguvu, haraka kutatua tope |
Mkusanyiko wa juu unaoruhusiwa (MPC) wa nitriti katika maji ya kunywa ya hifadhi ni 3.3 mg / l, nitrati - 45 mg / l.
Matone matatu ya suluhisho la diphenylamine iliyoandaliwa na asidi ya sulfuriki iliyojilimbikizia na matone moja au mawili ya maji yanayojaribiwa huwekwa kwenye kioo cha saa au slide ya kioo. Katika uwepo wa ioni za nitrati na nitriti, rangi ya bluu inaonekana, nguvu ambayo inategemea ukolezi wao.
Jedwali 8 Takriban maudhui ya jumla ya ioni za amonia na amonia katika maji
| Kuchorea wakati wa uchunguzi | Ioni za amonia na amonia | |||
| kutoka upande | juu | mg nitrojeni/l | mg ___/l | |
| Hapana | Hapana | 0,04 | 0,05 | |
| Hapana | Njano iliyofifia sana | 0,08 | 0,1 | |
| Njano iliyofifia sana | Hafifu njano | 0,2 | 0,3 | |
| Njano kidogo sana | Njano | 0,4 | 0,5 | |
| Hafifu njano | Njano nyepesi | 0,8 | 1,0 | |
| Njano | Rangi ya manjano ya hudhurungi | 2,0 | 2,5 | |
| Mawingu, njano mkali | Brown, ufumbuzi wa mawingu | 4,0 | 5,0 | |
| Suluhisho kali la kahawia, la mawingu | Brown, ufumbuzi wa mawingu | Zaidi ya 10.0 | Zaidi ya 10.0 | |
| Viumbe muhimu | ||||||
| Mabuu ya Stonefly |
Ugumu umegawanywa kuwa wa kudumu na wa muda, pia unajulikana kama kaboni, na ugumu unaoweza kutolewa unahusishwa na uwepo katika maji, pamoja na Ca 2+ na Mg 2+, ya hidrokaboni au bicarbonate anions (HCO 3). Ugumu wa muda unaweza kuondolewa kwa kuchemsha - kwa hiyo jina lake. Maji yanapochemshwa, anions bikaboneti huitikia pamoja na cations hizi na kuunda chumvi kidogo sana ya kaboni ya kaboni pamoja nao, ambayo hupungua.
Ca 2+ + 2HCO - 3 = CaCO 3 v+ H 2 O + CO 2 ^
Njia ya kuamua ugumu wa kaboni kwa kuweka sampuli ya maji na asidi hidrokloriki haipimi ugumu kama huo, ambayo ni, sio mkusanyiko wa Ca 2+ na Mg 2+, lakini alkalinity - mkusanyiko wa ioni za hydrocarbonate kwenye suluhisho.
Ikiwa unafuata madhubuti ufafanuzi wa ugumu wa carbonate, basi kipimo chake sahihi kinapaswa kutegemea kuchemsha kiasi fulani cha maji na kisha kupima sediment kusababisha (kiwango), lakini katika mazoezi hii ni vigumu kufikia. Ndio maana wanatenda tofauti.
Ugumu wa carbonate wa maji hutambuliwa kwa kuipunguza na asidi hidrokloric. Titration ni kuongeza ya ufumbuzi wa reagent kwa sampuli ya mtihani, mkusanyiko ambao unajulikana mapema. Kulingana na matumizi ya reagent hii - inaingiliana na dutu ambayo maudhui yao wanataka kuamua, mkusanyiko wa dutu inayotambuliwa huhesabiwa. Kwa mahitaji ya aquarium, ni rahisi kutumia ufumbuzi wa 0.05 M wa asidi hidrokloric. Kiashiria cha methyl machungwa pia kinahitajika, ambacho kinahitajika ili kuamua hatua ya mwisho ya titration.
> Kufanya uchambuzi
Pima kwa usahihi 50 ml ya maji yanayojaribiwa na kuongeza matone machache ya suluhisho la methyl orange.
Inapowekwa katika suluhisho, athari zifuatazo zitatokea:
Hebu tulinganishe hii na equation hapo juu, ambayo ilionyesha kile kinachotokea kwa bicarbonates za kalsiamu wakati wa kuchemsha. Kama ilivyo kwa kuchemsha, bidhaa za mwisho za athari hizi ni maji na kaboni dioksidi. Kalsiamu pekee haishiriki hapa, kwani ioni za hidrojeni ambazo huundwa katika suluhisho wakati HCl imeongezwa huko huguswa sio na ioni za kalsiamu, lakini kwa ioni za hidrokaboni.
Ni rahisi kuteka asidi ndani ya sindano hadi mgawanyiko uliowekwa alama mapema na kuiongeza kwenye suluhisho kwa vipimo. Mara ya kwanza, sehemu za asidi zinaweza kuwa kubwa, lakini hadi mwisho wa titration unahitaji kuwa makini na makini. Rangi inaweza kubadilika hata kutoka kwa tone moja. Uwezo wa suluhisho kuguswa na ioni za hidrojeni utapungua polepole asidi inapoongezwa na mwishowe itakuwa karibu kabisa - ioni za hydrocarbonate zitaisha na tone la mwisho la asidi litabadilisha pH kwa kasi, kwani kutakuwa na "hapana." moja” ili kufunga ioni za hidrojeni zinazotokea wakati wa kujitenga kwake katika maji. Kwa thamani ya pH chini ya 4, hakuna ioni zaidi za hidrokaboni katika suluhisho. Kiashiria kwa thamani hii ya pH itabadilisha rangi ya suluhisho kutoka njano hadi machungwa. Hapa titration lazima kusimamishwa. Ni bora kufanya utaratibu huu mara kadhaa, ukizingatia ni kiasi gani cha asidi kilichotumiwa. Kisha uhesabu kiasi cha wastani kinachotumiwa kwa titration ya asidi. Kujua kiasi hiki, ugumu wa carbonate huhesabiwa kwa kutumia formula:
Ugumu wa kaboni (mg-eq/l.) = (1000*C asidi * V asidi) / V maji
C asidi - mkusanyiko wa asidi katika moles;
Asidi ya V - kiasi cha suluhisho la asidi inayotumiwa wakati wa kuinua (ml)
V maji - kiasi cha sampuli ya maji iliyochukuliwa kwa titration (ml.)
Ikiwa C asidi = 0.05 M, na V maji = 50 ml, kisha ugumu wa carbonate (mg-eq/l.) = (1000*0.05*V asidi)/50 = V asidi
Hiyo ni, titration ya 50 ml ya maji na 0.05 M asidi hidrokloric, basi katika kesi hii ugumu wa carbonate ni katika mEq / l. Itakuwa sawa kiidadi na kiasi cha asidi (katika ml) kinachotumiwa kwa titration. Kwa mfano, ikiwa titration ilichukua 1.5 ml. ufumbuzi wa asidi, basi ugumu wa carbonate ya maji ni 1.5 mg - eq./l. Ili kubadilisha hadi digrii KH, thamani iko katika mEq/l. Lazima tuzidishe kwa 2.804.
1.5*2.804 = 4.2?KH
Kwa kweli, kwa kutumia njia hii tuliamua alkalinity ya maji, yaani, uwezo wake wa kumfunga ions hidrojeni ambayo hutengenezwa wakati wa kutengana kwa asidi hidrokloric katika maji.
Ioni za hydrocarbonate zinaweza kuingia maji sio tu wakati wa kufutwa kwa kalsiamu na kabonati za magnesiamu, lakini pia wakati wa kufutwa kwa chumvi zingine. Soda ya kuoka inayojulikana ni mfano wa kiwanja kama hicho, NaHCO 3. Ikiwa unaongeza soda ya kuoka kwenye aquarium, itafuta na kutoa ioni za sodiamu na bicarbonate. Ioni za hidrokaboni huunganisha ioni za hidrojeni kwao wenyewe, hivyo maji katika aquarium inakuwa chini ya tindikali au inakuwa ya alkali baada ya kuongeza soda ya kuoka, lakini hii inategemea kipimo. Viongezeo vidogo vyake vitalinda dhidi ya kuongezeka kwa pH isiyotarajiwa. Unaweza kuamua ikiwa soda ya kutosha huongezwa au la kwa kupima alkalinity. Kujua alkalinity, unaweza kutathmini ni kiasi gani maji katika aquarium inaweza kupinga acidification, yaani, kutathmini uwezo wa buffering. Ikiwa alkalinity ya maji safi ni ya chini (chini ya mg/eq/l), basi uwezo wake wa kuakibisha ni mdogo. Maji kama hayo yanaweza kugeuka kuwa siki ghafla, kwa mfano, ikiwa kichujio kitaacha ghafla. Kiwango cha alkali cha 1.2-2 mEq/l kinafaa kwa samaki na mimea mingi. Katika kesi hii, uwezo wa kuhifadhi maji utatosha kudumisha athari thabiti ya pH ya maji. Kawaida alkalinity maji ya aquarium inageuka tu kuwa katika safu maalum au hata ina maadili ya juu zaidi ya 3 mEq / l na ya juu (katika kesi hii, shida za kukuza mimea mingi na uvamizi wa mwani zinawezekana). Katika mikoa yenye maji laini, yenye asidi kidogo, inaweza kuwa chini sana. Ikiwa umeongeza soda kwenye aquarium ili kuinua na kuimarisha pH, basi usipaswi kushangaa ikiwa "ugumu wa carbonate" ghafla unazidi jumla. Ikiwa NaHCO 3, yaani, ioni za hydrocarbonate zisizohusishwa na kalsiamu na magnesiamu, ziliongezwa kwa maji ya aquarium, basi kwa kawaida kutakuwa na zaidi ya Ca 2+ na Mg 2+ ions. Hiki ndicho kiini cha kitendawili, wakati formula:
Ugumu wa jumla = Ugumu wa kudumu + Ugumu wa muda hauridhiki kutokana na ukweli kwamba ule wa muda ni mkubwa kuliko jumla.
nguvu ya maji ya shinikizo la joto
Ioni za chuma za alkali (kalsiamu, magnesiamu, bariamu, berili, nk) hupasuka katika maji safi, jumla ya ambayo hutoa ugumu wa maji.
Kwa mujibu wa GOST nchini Urusi, ugumu wa maji huchukuliwa kuwa mkusanyiko wa ioni za kalsiamu na magnesiamu, iliyoonyeshwa kwa millimoles kwa lita (wingi sawa na 1 mmol ni sawa na 20.04 mg ya kalsiamu au 12.16 mg ya magnesiamu). Katika mazoezi yetu ya aquarium, ugumu unaonyeshwa kwa digrii za Ujerumani. Kiwango kimoja cha ugumu kinalingana na maudhui ya 10 mg ya CaO au 7.19 mg ya MgO katika lita 1 ya maji. Unaweza kujua ugumu wa maji ya bomba kwenye kituo cha usambazaji wa maji au kwenye ofisi ya ukaguzi wa usafi na mifugo. Huko watatoa thamani ya ugumu iliyoonyeshwa kwa mmol / l, ambayo lazima iongezwe na 2.8 ili kubadilisha digrii.
Jumla ya ugumu (dH) ni jumla ya carbonate (ya muda) na ugumu wa kudumu.
Ugumu wa kaboni (ya muda) (KH) huundwa na chumvi inayoundwa kutoka kwa mchanganyiko wa kalsiamu au magnesiamu na dioksidi kaboni, ambayo ni kalsiamu na bicarbonates ya magnesiamu. Wakati maji yanapochemshwa, bicarbonates hutengana, na kutengeneza kabonati za mumunyifu kidogo ambazo hupanda, na ugumu wa maji hupungua. Kweli, ikiwa maji hayo yameachwa kusimama kwa muda mrefu, basi baadhi ya carbonates itaingia tena kwenye suluhisho (hasa katika maji ya alkali) na thamani ya KN itaongezeka.
Katika maandiko, wakati wa kuelezea hydrochemistry ya hifadhi, mtu anaweza wakati mwingine kukutana na ukweli wa paradoxical kwamba thamani ya ugumu wa carbonate huzidi thamani ya ugumu wa jumla.
Ukweli ni kwamba wakati wa kupima ugumu wa jumla, ioni za ardhi za alkali pekee huzingatiwa, na pamoja na carbonates ya vipengele vya dunia ya alkali, pia kuna misombo ya carbonate kama vile, kwa mfano, carbonate ya sodiamu au carbonate ya potasiamu. Na ikiwa zimo ndani ya maji kiasi kikubwa na kuzingatiwa wakati wa kupima ugumu wa carbonate, inaweza kuwa ya juu kuliko jumla.
Ugumu wa mara kwa mara pia unahusishwa na ioni za chuma za alkali duniani. Inasababishwa na misombo mingine kama vile salfati, kloridi, nitrati, silikati na phosphates, na thamani yake, tofauti na ugumu wa muda, haiwezi kupunguzwa kwa kuchemsha maji.
Ugumu wa jumla wa maji kutoka 0 hadi 5 ° huitwa laini sana, kutoka 5 hadi 10 ° - laini, kutoka 10 hadi 20 ° - ngumu ya kati, kutoka 20 hadi 30 ° - ngumu na zaidi ya 30 ° - ngumu sana.
Ugumu wa maji unaweza kubadilika chini ya ushawishi wa mambo mbalimbali (utoaji wa CO 2 na samaki au ngozi ya CO 2 na mimea, mabadiliko ya thamani ya pH, kufutwa kwa chokaa cha udongo, nk).
Katika aquarium iliyopandwa na mimea, na idadi ndogo ya samaki na katika taa kali, ugumu unaweza kubadilika siku nzima. Wakati wa mchana, mimea huchukua dioksidi kaboni na nguvu ya taa, mchakato huu unafanyika zaidi. Hatimaye kunaweza kuja wakati ambapo hakuna kaboni dioksidi ya kutosha kukidhi mahitaji ya mimea. Kisha, mimea kama elodea itaanza kuizalisha kutoka kwa bicarbonates. Mmenyuko utatokea - Ca(HCO 3) 2 => CO 2 + H 2 O + CaCO 3 - na ugumu wa muda wa maji utapungua. Usiku, mimea haichukui kaboni dioksidi, lakini, kama samaki, huitoa wakati wa kupumua. Mchakato utaenda kinyume na rigidity itaongezeka. Kesi hii ni hatari sana katika aquarium ambayo mwani mdogo wa kijani umekua na maji yamegeuka kijani.
Vitendanishi mbalimbali vinapatikana kibiashara makampuni ya kigeni, kukuwezesha kuamua haraka jumla na ugumu wa kaboni ya maji (kwa mfano, GH & KH TEST, FRESHWATER HARDNESS TEST KIT na wengine).
Unaweza kuamua ugumu wa maji kwa kutumia njia ya sabuni ya coarser, kwa kuzingatia ukweli kwamba 10 mg ya oksidi ya kalsiamu katika lita 1 ya maji haipatikani na 0.1 g ya sabuni safi. Kwa kufanya hivyo, sabuni ya kufulia 60-72% imevunjwa kutoka mwisho wa bar, vunja 2-3 g na diluted katika maji ya joto distilled. Kisha mimina ndani ya burette au glasi na mgawanyiko ili iwezekanavyo kupima sehemu za suluhisho iliyo na 0.1 g ya sabuni. Lita 1 ya maji ya aquarium hutiwa ndani ya jar na kisha, wakati wa kutetemeka, sehemu za suluhisho hutiwa, kila moja ina 0.1 g ya sabuni. Wakati Bubbles za sabuni zilizo na alama ya upinde wa mvua zinaonekana kwenye uso wa maji, operesheni imekamilika. Idadi ya huduma kwa 0.1 g ya sabuni ni sawa na idadi ya digrii za ugumu wa maji. Kwa uzoefu wa kutosha wa kipimo, hitilafu itakuwa ±1 °. Ikiwa ugumu wa maji ni zaidi ya 12 °, usahihi wa kipimo hupungua na sampuli ya maji inapaswa kupunguzwa kwa nusu na maji yaliyotiwa maji, na matokeo ya kipimo lazima yazidishwe na 2.
Wakati wa kuandaa maji kwa ajili ya kuzaliana samaki, mara nyingi ni muhimu kubadili ugumu wake. Kuna njia kadhaa za kufanya hivyo.
Njia za kupunguza ugumu wa maji.
1. Maji ya kuchemsha
Maji hutiwa ndani sahani za enamel na chemsha kwa dakika 15-20, kisha baridi na ukimbie 2/3 ya safu ya juu, ambayo ugumu wake utapungua kwa sababu ya mvua ya chumvi ya kalsiamu na magnesiamu.
2. Kuganda
Maji hutiwa ndani kipenyo kikubwa, chini (cm 15-25), chombo cha plastiki kinachostahimili baridi, ambacho hutolewa nje kwenye baridi au kuwekwa kwenye freezer. Baada ya kuona kupitia ukuta wa chombo kwamba maji yamegandishwa katikati, barafu huvunjwa na maji hutiwa. Maji yaliyopatikana kutoka kwa barafu kawaida huwa na ugumu (kulingana na asili) ya 1-3 °.
3. kunereka
Vipande vya porcelaini vimewekwa chini ya chombo kilichotengenezwa kwa nyenzo sugu ya joto ili kuhakikisha kuchemsha kwa usawa, maji hutiwa ndani, na imefungwa na kizuizi na shimo ambalo mwisho wa bomba la glasi au coil iliyounganishwa na friji imeingizwa. Maji yanapochemshwa, mvuke wake hujifunga kwenye jokofu, na maji yaliyosafishwa hutiririka ndani ya chombo. Ugumu wa maji yanayotokana ni 0.8-2.3 °. Ikiwa ni lazima, unaweza kufuta tena na kupata maji kwa ugumu wa 0.2-0.8 °. Hasara ya mchakato ni uzalishaji mdogo.
Wakati wa kuandaa maji kwa ajili ya kuzaliana kwa samaki, maji yaliyotengenezwa hutiwa ndani ya chombo kilichohifadhiwa kutoka kwa vumbi na kushoto kwa wiki 1.5-2. Wakati huu, CO 2 ya ziada itayeyuka kutoka kwayo na pH itakuwa karibu na 7.
4. Matumizi ya madawa ya kulevya makampuni ya kigeni ili kupunguza ugumu wa maji, kwa mfano, WATER SOFTERNER PILLOW ili kupunguza ugumu wa carbonate, ambayo ni mfuko wa mesh ya synthetic iliyojaa resin maalum ya kubadilishana ion ambayo huondoa ioni za kalsiamu na magnesiamu kutoka kwa maji, ambayo huongeza ugumu wa muda. Aina mbili za mifuko zinapatikana: N№ 49 A - kwa aquariums yenye kiasi cha lita 80 na N№ 49 B - kwa aquariums yenye kiasi cha zaidi ya lita 80.
5. Kuchanganya na maji laini
Kabla ya kuchanganya maji ya bomba moto kwa dakika 40 kwa 90 ° C na kisha kilichopozwa katika hewa.
Q = (H 1 – h) : (H 2 – h),
ambapo H 1 ni ugumu wa chanzo cha maji, H 2 ni ugumu wa maji kupatikana, h ni ugumu wa maji yaliyoongezwa, Q ni idadi ya sehemu za maji yaliyoongezwa kwa sehemu moja ya awali.
6. Uondoaji wa kemikali kwa kutumia vibadilishaji ioni vya MA-6
Nyenzo za kubadilishana ion zinazotumiwa katika teknolojia kawaida hutegemea polystyrene au polyacrete. Nyenzo za kubadilishana hutumiwa kwa kawaida katika fomu ya punjepunje au perforated na kipenyo cha milimita kadhaa. Shukrani kwa kubadilishana ioni za kisasa, inawezekana kupunguza ugumu wa jumla, ugumu wa carbonate, maudhui ya chumvi jumla, kuondoa nitrati, vitu vya kikaboni na metali nzito. Nyenzo za kubadilishana ion zimeundwa ili waweze kubadilishana tu ions za malipo sawa. Kwa hivyo, resini za kubadilishana ion ambazo hubadilisha ioni (cations) zenye chaji chanya huitwa kubadilishana kwa mawasiliano, na zile zinazobadilishana ioni zenye chaji hasi (anions) huitwa kubadilishana kwa anion.
Vifaa vya kuondoa chumvi kwenye maji kwa kawaida huwa na safu wima mbili zilizounganishwa kwa mfululizo. Kwanza, maji hutolewa kwenye safu ya kwanza na resin ya kubadilishana cation, ambayo imejaa ioni za hidrojeni, kisha hupitia safu ya pili na resin ya kubadilishana ya anion, iliyojaa ions hidroxyl. Wakati maji ya bomba yanapopita ndani yake, kibadilishaji cha mawasiliano hubadilisha cations zote (Ca +, Mg +, nk) kwa cation ya hidrojeni H +, mchanganyiko wa anion hubadilisha anions zote (SO 4 -, Cl -, nk) kwa hidroksili. ioni OH -. Ioni ya hidrojeni kutoka kwa kichanganishi cha mshikamano huchanganyika na ioni ya hidroksili kutoka kwa kibadilishaji anion na kutoa H 2 O. Mwitikio katika safu wima ya kwanza unaweza kurahisishwa kwa fomula ifuatayo: H + +Na + Cl - => Na+H + Cl. -. Katika hatua ya kwanza, cation ya chumvi (kwa upande wetu sodiamu) inafunga kwa resin ya kubadilishana ioni, ambayo hutoa ioni ya hidrojeni kwa kusudi hili. Inarudi kwenye nafasi ya sodiamu na hufanya asidi hidrokloric. Mmenyuko unaofanyika katika safu ya pili, iliyopakiwa na ioni za hidroksili, inaweza kuwakilishwa na fomula ifuatayo: OH - + H + Cl - => Cl + H 2 O. Kwa hivyo, klorini hufunga kwa resin ya ionic na tunapata maji. molekuli.
Kwa kupitisha maji ya bomba mfululizo kupitia kibadilisha mawasiliano na kibadilishaji anion, tunapata maji yaliyotiwa chumvi kabisa.
Kampuni nyingi hutoa safu wima za kubadilishana ioni, kama vile safu wima ya kubadilishana ioni ya Tap Water Purifier kutoka Aquarium Pharmaceuticals.
Unaweza kufanya ufungaji kwa ajili ya kufuta kemikali kwa kutumia kubadilishana ion mwenyewe. Inajumuisha nguzo mbili (moja yao imekusudiwa kwa kubadilishana mawasiliano, nyingine kwa mchanganyiko wa anion) yenye urefu wa karibu 600 mm na kiasi cha lita 3. Hizi zinaweza kuwa mitungi ya glasi au parallelepipeds za mstatili zilizounganishwa kutoka kwa glasi au plexiglass. Silinda ya kioo imefungwa kwa pande zote mbili na vizuizi vya mpira na shimo katikati ambayo mirija huingizwa. Ikiwa hizi ni parallelepipeds, basi zimefungwa na vifuniko na kuunganisha glued ambayo tube huwekwa. Plugi na kofia zote mbili lazima zihakikishe muunganisho mkali kwenye safu wima. Lazima kuwe na chujio chini ya kila silinda ili kuzuia nafaka za resini kuvuja nje ya safu. I. Vanyushin anaelezea muundo wake kwa njia hii: "Vitenganishi ni sahani za mesh (zilizotoboa) ambazo hurudia vipimo vya ndani vya nguzo. Kichujio kinawekwa kati ya watenganishaji, kuzuia kuvuja kwa nafaka za resin, lakini kwa uhuru kuruhusu kioevu kupita. Vitenganishi na vichungi lazima vifanywe kwa nyenzo sugu za kemikali. Ninatumia matundu ya kitenganishi cha betri na nyuzi sintetiki kwa kusudi hili.
Wabadilishaji wa ion huvimba ndani ya maji, na ili kuwazuia kuvunja mitungi, hujazwa na maji kwenye chombo tofauti na kushoto kwa masaa 10-12.
Kisha mchanganyiko wa cation hutiwa ndani ya silinda, suluhisho la 5% la asidi hidrokloriki katika maji yaliyotengenezwa hupitishwa kupitia hiyo kwa kiwango cha 400 ml ya suluhisho kwa 100 g ya mchanganyiko kavu wa mawasiliano na kuosha na maji yaliyotengenezwa kwa kiasi kikubwa mara 2. kuliko kiasi cha suluhisho la asidi inayotumiwa. Mchanganyiko wa anion hutiwa kwenye silinda nyingine, suluhisho la 5% ya hidroksidi ya sodiamu katika maji yaliyosafishwa hupitishwa kupitia hiyo kwa kiwango cha 300 ml ya suluhisho kwa 100 g ya mchanganyiko kavu wa anion na kuosha na maji yaliyotengenezwa kwa kiasi kikubwa mara 3 kuliko. kiasi cha ufumbuzi wa alkali unaotumiwa.
Sasa nguzo zimeunganishwa na zilizopo na maji ya bomba hupitishwa kupitia kwao. Ugumu wa maji yanayotokana ni 0.2-0.4 °. Wakati ugumu unapoanza kuongezeka, ni muhimu kurejesha kubadilishana ioni, ili kufanya hivyo, kuzima mitungi na kutibu mchanganyiko wa ioni katika kesi moja na asidi, kwa nyingine na alkali, kama ilivyoonyeshwa hapo juu. Wakati haitumiki, mitungi lazima ijazwe na kubadilishana kwa ion ambayo imeachwa bila kutumika kwa muda mrefu inahitaji kufanywa upya.
I. Vanyushin hulipa kipaumbele kikubwa kwa kutokuwepo kwa Bubbles za hewa kwenye nguzo. Anaandika: “Kwanza, teremsha kichungi na vitenganishi kwenye safu na ujaze na glasi 1.5–2 za maji ili maji yasitoke kwenye safu; Kisha resin, iliyotiwa kwa masaa 24 na kuosha vizuri, inahamishiwa kwenye safu. Wakati wa kupakia resin, ni muhimu kuongeza maji kama inahitajika ili Bubbles za hewa hazifanyike ndani ya wingi, ambayo, kutenganisha sehemu ya resin, kuitenga kufanya kazi.
Safu inapaswa kujazwa hadi 2/3–3/4 ya ujazo wake. Nafasi iliyobaki ni muhimu kwa harakati ya bure ya nafaka za resin wakati kiasi chao kinabadilika na gesi hutolewa.
Baada ya kujaza nguzo, kofia zimewekwa juu yao, ambazo zinapaswa kuziba safu kwa hermetically. Ninatumia plastiki ili kuhakikisha muhuri mkali.
Ikiwa Bubbles za hewa huunda katika molekuli ya resin wakati wa kupakia, lazima ziondolewa kabla ya kuzaliwa upya kuanza. Ili kufanya hivyo, bomba la plagi ya mpira hutiwa ndani ya jarida la lita nusu iliyojaa maji na kupunguzwa chini ya safu. Baada ya hewa kutoka kwenye bomba, jar pamoja na bomba huinuliwa haraka juu ya kiwango cha safu ili maji kutoka kwenye jar huanza kurudi kwenye safu. Shukrani kwa hili, resin huongezeka kwa muda mrefu kama kiasi cha ndani cha bure kinaruhusu. Kisha bomba hufungwa. Katika safu ya maji iliyoundwa chini ya resin, "kupanga" huanza mara moja: resin hukaa kwenye chujio, na Bubbles za hewa hukimbilia juu. Hatua kwa hatua kupanda, safu ya maji inaonekana kusindika resin yote. Ikiwa kuna hitch, unaweza kuitingisha msemaji kidogo. Ikiwa mzunguko mmoja haitoshi kuondoa kabisa hewa, mchakato lazima urudiwe, ukimbie maji ya ziada kutoka kwenye safu.
Utaratibu huo lazima urudiwe kabla ya kuosha baada ya kuzaliwa upya, bila kujali uwepo wa Bubbles za gesi kwenye resin. Ukweli ni kwamba wakati wa malipo, resin hupunguza kiasi chake, na inapoosha huvimba tena, na ikiwa haijafunguliwa kwa njia iliyoelezwa hapo juu, inaweza kuvunja safu. Kufungua vile na kuondolewa kwa wakati mmoja wa gesi iliyotolewa kunapaswa kufanywa hata baada ya muda mrefu wa kutofanya kazi kwa usakinishaji.
7. Electrolysis
Ili kuandaa maji laini, Katasonov alipendekeza kutumia kifaa kilichopendekezwa na Krotov kupata maji "laini" na "hai". Muundo anaotumia una kopo la enamel yenye ujazo wa lita 3, ambamo glasi yenye urefu wa mm 185 na kipenyo cha mm 65 huwekwa, iliyoshonwa kutoka kwa turubai nene na nyuzi za nailoni, na elektroni mbili za chuma cha pua zenye ukubwa wa 190x30 mm na 1.5– Unene wa mm 2, inapokea nguvu kutoka kwa njia kuu za AC 220V kupitia daraja la diode. Kifaa kama hicho baada ya dakika 10. kazi inakuwezesha kupata lita 2.5 za maji na ugumu wa 0 ° na pH 4.2, ambayo ina rangi ya njano ya limau, harufu ya siki na iko kwenye can yenyewe (maji "yaliyokufa"). Maji hutiwa ndani ya chombo, kuruhusiwa baridi na kisha alkali na soda ya kuoka mpaka thamani inayotakiwa pH, baada ya hapo inaruhusiwa kukaa kwa siku kadhaa, wakati ambapo maji yatatoka na sediment ya rangi ya njano itajilimbikiza chini.
8. Mvua au maji ya theluji
Matumizi ya mvua au maji ya theluji, ambayo ina ugumu wa hadi 3 °, inaweza kupendekezwa tu katika maeneo ambayo anga haijachafuliwa na taka ya viwanda. Kwa hali yoyote, inahitaji kushoto kwa wiki kadhaa, na kisha, ikichukua safu ya juu, iliyochujwa kupitia kaboni iliyoamilishwa na kuingizwa kwa siku kadhaa, baada ya hapo, iliyochanganywa kwa uwiano unaohitajika na maji ya kawaida ili kupata ugumu unaohitajika na pH; jaribu kufaa kwa maji kwenye samaki wa bei nafuu.
Njia za kuongeza ugumu wa maji.
1. Maji ya kuchemsha
Maji huchemshwa kama ilivyoelezwa hapo juu, lakini safu ya chini hutumiwa.
2. Kuchanganya na maji magumu zaidi
Hesabu inafanywa kwa kutumia formula iliyotolewa hapo juu.
3. Kuongeza kemikali
Kuongeza 18.3 ml ya ufumbuzi wa 10% ya kloridi ya kalsiamu au 19.7 ml ya ufumbuzi wa 10% ya sulfate ya magnesiamu kwa maji huongeza ugumu wa lita 100 za maji kwa 1 °. Ni vyema kuongeza ufumbuzi kwa kiasi sawa.
Tayari tumeandika juu ya "ugumu wa maji ya aquarium ni nini na jinsi inavyoonyeshwa." Lakini napenda kukukumbusha kwa ufupi kwamba rigidity imegawanywa kuwa ya kudumu na ya muda. Muda, yeye ni sawa kabonati, yeye ni sawa inayoweza kutolewa ugumu unahusishwa na uwepo katika maji pamoja na cations Ca 2+ na Mg 2+ hidrokaboni, au anions ya bicarbonate (HCO 3 - ). Maji yanapochemshwa, anions bikaboneti huitikia pamoja na cations hizi na kuunda chumvi kidogo sana ya kaboni ya kaboni pamoja nao, ambayo hupungua.
Ca 2+ + 2HCO 3 - = CaCO 3 ↓ + H 2 O + CO 2
Ugumu wa muda unaweza kuwa kuondoa kuchemsha - kwa hivyo jina lake. Sio hatari kwa mwana aquarist kujua ugumu wa carbonate ya maji katika aquariums yake. Hii ni kiashiria muhimu cha hydrochemical, ambayo mara nyingi hutolewa katika maandiko ya kumbukumbu kuhusu masharti ya uhifadhi na kuzaliana kwa samaki. Ni muhimu kuzingatia kiashiria hiki wakati wa kukua mimea mingi ya aquarium. Aquarists wengi wana hakika kwamba kwa kutumia vipimo vya matone kwa ugumu wa carbonate (CH) kuuzwa katika maduka, huamua hii hasa. Lakini huku ni KUTOELEWA kwa kuchekesha! Vipimo vya matone kwa aquarists amateur, na vile vile mbinu ya classic Kuamua ugumu wa kaboni kwa kuweka sampuli ya maji na asidi hidrokloriki hakupimi ugumu kama huo, ambayo ni, sio mkusanyiko wa ioni za kalsiamu na magnesiamu, lakini alkalinity - mkusanyiko wa ions hidrocarbonate katika suluhisho. Ioni za hydrocarbonate zinaweza kuishia ndani ya maji sio tu wakati chumvi za kalsiamu na magnesiamu zinayeyushwa, kwa hivyo si rahisi kila wakati kuhukumu uwepo wa Ca 2+ na Mg 2+ ioni kwa yaliyomo kwenye ioni za hidrokaboni. Lakini, mambo ya kwanza kwanza ...
Ikiwa unafuata madhubuti ufafanuzi wa ugumu wa carbonate, basi kipimo chake sahihi kinapaswa kutegemea kuchemsha kiasi fulani cha maji na kisha kupima sediment kusababisha (kiwango). Katika mazoezi hii ni vigumu kufikia. Ndio maana wanatenda tofauti. Hapa ni jinsi ya kuamua "ugumu wa carbonate" kwa kutumia mbinu ya kawaida ya maabara.
Uamuzi wa ugumu wa carbonate ya maji unafanywa kwa kuipunguza na asidi hidrokloric. Titration ni kuongeza ya ufumbuzi wa reagent, mkusanyiko ambao unajulikana mapema, kwa sampuli ya mtihani. Kulingana na matumizi ya reagent hii - inaingiliana na dutu ambayo maudhui yao wanataka kuamua, mkusanyiko wa dutu inayotambuliwa huhesabiwa. Katika mtihani huu, ni desturi kutumia ufumbuzi wa 0.05 M wa asidi hidrokloric (unaweza kusoma kuhusu kile kifupi "M" kinamaanisha). Kwa kuongeza, utahitaji kiashiria methyl machungwa
, ambayo ni muhimu ili kuanzisha hatua ya mwisho ya titration kulingana na mabadiliko ya ghafla rangi za sampuli. Ili kuandaa suluhisho la kiashiria, kiasi kidogo cha hiyo, 0.1 g, hupasuka katika 100 ml ya maji yaliyotengenezwa. Usahihi hauhitajiki hapa; kila kitu kinaweza kufanywa kwa jicho.
Kama sheria, vitendanishi hivi vinapatikana katika maabara yoyote ya kemikali.
Kufanya mtihani wa maabara kwa ugumu wa kaboni:
Pima kwa usahihi 50 ml ya maji yanayojaribiwa. Ongeza matone machache ya suluhisho la machungwa ya methyl, kiasi kwamba rangi ya sampuli inageuka kuwa sawa na kwenye glasi ya kushoto kwenye takwimu hapa chini:
Inapowekwa katika suluhisho, athari zifuatazo zitatokea:
H++HCO3 - <->H2CO3<->CO 2 + H 2 O
Hebu tulinganishe hii na equation hapo juu, ambayo ilionyesha kile kinachotokea kwa bicarbonate ya kalsiamu wakati wa kuchemshwa. Kama ilivyo kwa kuchemsha, bidhaa za mwisho za athari hizi ni maji na dioksidi kaboni. Kalsiamu pekee haihusiki kwa njia yoyote hapa. Hii inaeleweka, kwa sababu ioni za hidrojeni zinazoingia kwenye maji ya mtihani wakati asidi hidrokloriki imeongezwa huko huguswa sio na ioni za kalsiamu, lakini kwa ioni za hidrokaboni.
Ni rahisi kuteka asidi ndani ya sindano hadi mgawanyiko uliowekwa alama mapema na kuiongeza kwenye suluhisho kwa vipimo. Mara ya kwanza, sehemu za asidi zinaweza kuwa kubwa, lakini hadi mwisho wa titration unahitaji kuwa makini na makini, rangi inaweza kubadilika halisi kutoka kwa tone moja. Uwezo wa maji yaliyojaribiwa kuguswa na ioni za hidrojeni utapungua polepole asidi inapoongezwa na, mwishowe, itakuwa karibu kumaliza kabisa - ioni za bicarbonate zitaisha na tone la mwisho la asidi litabadilika sana kuelekea maadili ya asidi, kwani tayari itafunga ioni za hidrojeni zinazotokea wakati wa kutengana kwake katika maji "hakuna mtu." Kwa thamani ya pH chini ya 4.3, hakuna ioni za hydrocarbonate zaidi katika suluhisho (zaidi kuhusu hili linajadiliwa). Kiashiria kwa thamani hii ya pH itabadilisha rangi ya suluhisho kutoka njano hadi machungwa. Hapa titration itahitaji kusimamishwa. Unahitaji kutikisa polepole, ukizungusha maji kwa uangalifu kwenye glasi. Ni bora kufanya utaratibu huu mara kadhaa, ukizingatia ni kiasi gani cha asidi kilichotumiwa. Kisha ukokotoa WASTANI WA KIASI cha asidi inayotumika kukadiria. Kujua kiasi hiki, ugumu wa carbonate huhesabiwa kwa kutumia formula:
Ugumu wa kaboni(mg-eq/l) = (1000*C asidi *V asidi):V maji
Ambapo asidi C ni mkusanyiko wa asidi katika moles (M/l), asidi V ni kiasi cha mmumunyo wa asidi unaotumiwa wakati wa titration (ml), V maji ni kiasi cha sampuli ya maji iliyochukuliwa kwa titration (ml).
Kama Na asidi = 0.05 M, A V maji = 50 ml, Hiyo
Ugumu wa kaboni(mg-eq/l) = (1000*0.05*V asidi):50 = V asidi
Hiyo ni, ikiwa ulipunguza 50 ml ya maji na asidi hidrokloriki 0.05 M, basi katika kesi hii ugumu wa carbonate katika mEq/L utakuwa sawa na kiasi cha asidi (katika ml) kutumika kwa titration. Kwa mfano, ikiwa titration ilichukua 1.5 ml ya suluhisho la asidi, basi ugumu wa carbonate wa maji ni 1.5 mEq/L. Ili kubadilisha hadi digrii KH, thamani katika mEq/l lazima iongezwe kwa 2.804: 1.5*2.804=4.2°KH.
Ningependa tena kuteka mawazo yako kwa ukweli kwamba njia ya uchambuzi wa maji iliyoelezwa hapa inaitwa kawaida njia ya kuamua "ugumu wa kaboni". Kwa kweli, kwa njia hii tuliamua ALKALINITY ya maji, yaani, uwezo wake wa kumfunga ioni za hidrojeni ambazo hutengenezwa wakati wa kutengana kwa asidi kali katika maji. Vipimo vya matone ya kibiashara kwa maji ya aquarium (KH-test, au KH test) pia hutegemea maji ya titrating na asidi na, kama mtihani wa maabara ulioelezwa hapo juu, huamua alkalinity. Inapaswa kuzingatiwa kuwa maadili ya KH yaliyoonyeshwa katika fasihi ya kumbukumbu hayaonyeshi yaliyomo kwenye kalsiamu na bicarbonates za magnesiamu ndani ya maji, kama kawaida huandikwa katika vitabu vyote vya aquarium, lakini ambayo ni alkalinity, ambayo ni, bicarbonates yoyote na nyingine. anions ambazo zinaweza kuguswa na ioni za hidrojeni. Je, hii ni nzuri au mbaya? Uwezekano mkubwa zaidi - mzuri. Ni muhimu kwa mtaalamu wa aquarist kujua ni kiasi gani maji katika aquarium yake yanaweza kupinga asidi (neutralize ioni za hidrojeni zinazoingia ndani yake) Na ni kiasi gani cha maji kama hayo yataondoka kwenye kuta za mabomba kwenye mfumo wa joto, na hivyo kupunguza uhamisho wa joto, haimjali sana, isipokuwa bila shaka yeye ni mhandisi wa joto. Tukumbuke kuwa ugumu wa maji sio dhana ya kisayansi, lakini ni ya matumizi tu, lakini hii tayari imejadiliwa. iliyoandikwa mapema.
Kama tulivyoona tayari, ioni za bicarbonate zinaweza kuingia ndani ya maji sio tu wakati wa kufutwa kwa kaboni ya kalsiamu na magnesiamu, lakini pia wakati wa kufutwa kwa chumvi zingine. Soda ya kuoka inayojulikana ni mfano wa kiwanja kama hiki: NaHCO 3. Ikiwa unaongeza soda ya kuoka kwenye aquarium, basi wakati itapasuka itatoa ioni za sodiamu na bicarbonate (jinsi chumvi hupasuka katika maji imeelezewa katika makala juu ya mineralization ya maji). Ioni za hydrocarbonate, kama tunavyojua tayari, ambatisha ioni za hidrojeni kwao wenyewe, kwa hivyo maji kwenye aquarium kutoka kwa kuongezwa kwa soda ya kuoka huwa chini ya asidi au hupata majibu ya alkali - yote inategemea kipimo. Hii hapa ni bidhaa ya pH+ kwa ajili yako! Soda ya kuoka kwa kweli hutumiwa na aquarists wengi. Viongezeo vidogo vyake vitalinda dhidi ya kuongezeka kwa pH usiyotarajiwa. Unaweza kuamua ikiwa soda ya kutosha huongezwa au la kwa kupima alkalinity. Kujua alkalinity, unaweza kutathmini ni kiasi gani maji katika aquarium yako inaweza kupinga asidi - kama wanasema, tathmini BUFFERING. Ikiwa alkalinity ya maji safi ni ya chini (chini ya 1 mEq/l, au 2.804 o KN ), basi uwezo wake wa bafa ni mdogo. Maji kama hayo yanaweza kugeuka kuwa siki ghafla, kwa mfano, unaporuka nyingine au unapozima uingizaji hewa usiku. Kiwango cha alkalinity cha 1.2-1.8 mg-eq/l, au 3 - 5 o KN kinafaa kwa samaki na mimea mingi. Katika kesi hii, uwezo wa kuhifadhi maji utatosha kudumisha mmenyuko thabiti wa maji - pH. Kwa kawaida, alkalinity ya maji ya aquarium iko katika safu maalum au hata ina maadili ya juu zaidi - 2.5 mg-eq / l, au 7 kuhusu KN na ya juu (katika kesi hii, matatizo ya kukua mimea mingi na uvamizi wa mwani inawezekana. ) Lakini katika mikoa yenye maji laini, yenye asidi kidogo inaweza kuwa chini sana. Kwa hiyo, katika wilaya nyingi za St maji ya bomba ina alkalinity ya 0.5 mEq/l. Kwa hiyo, wapenzi wengi wa cichlids za Kiafrika, ambao maji ya asidi ni kisu mkali, huinua kwa bandia kwa msaada wa soda ya kuoka. Lakini! Ikiwa umeongeza soda kwenye aquarium ili kuinua na kuimarisha pH, basi usipaswi kushangaa ikiwa "ugumu wa carbonate" ghafla unazidi jumla. Kwa njia, kuna pia maji ya asili Na ugumu wa carbonate kuzidi jumla, kwa mfano, maji ya Ziwa Tanganyika. Matokeo haya yanaweza kushangaza ikiwa hujui ni kipimo gani cha ugumu wa kaboni. Ikiwa umeongeza NaHCO kwenye maji ya aquarium 3 , yaani, ioni za hydrocarbonate zisizohusishwa na kalsiamu na magnesiamu, basi, kwa kawaida, kutakuwa na zaidi kuliko Ca ions 2+ na Mg 2+ . Hii ndio kiini cha kitendawili, wakati formula ya kimantiki kabisa:
Ugumu wa jumla = Ugumu wa kudumu + Ugumu wa muda
inashindwa kutokana na ukweli kwamba ya muda zaidi ya jumla.
Kuelewa kiini cha mambo wakati mwingine inakuwezesha kuunda miujiza, angalau machoni pa mtu asiyejua. Kwa namna fulani wanatuletea maji ya aquarium kwa uchambuzi. Tunahitaji kufikiria, samaki wanaendelea kufa na kufa. Alipoulizwa ikiwa pH ilipimwa? Tulihakikishiwa kuwa kila kitu kilikuwa sawa na pH. Sawa. Tulianza kwa kupima ugumu wa jumla, kisha tukaamua ugumu wa kaboni. Ilibadilika kuwa moja ya carbonate ni mara kadhaa zaidi kuliko ya jumla. Kila kitu tayari kiko wazi hapa. Tunauliza - kwa nini unamwaga soda nyingi kwenye aquarium? Tulishangaa sana jinsi tulivyogundua kuhusu soda. Inatokea kwamba kuongeza soda katika kila mabadiliko ya maji ni siri na maalum njia ya ufanisi ilipendekeza kwa njia ya marafiki na mtaalam. Inadaiwa inahakikisha pH ya ajabu na bora kabisa. Hata ukisafisha aquariums mara chache, maji hayatageuka kuwa siki. Haitageuka kuwa siki. Lakini ni nini thamani ya pH? Je, umepima? Utakuwa na zaidi ya 8. Na samaki hufa sio tu kutokana na maji yenye asidi. Hapana, wanajibu, hatukupima. Tulifanya mtihani wa pH. Ilionyesha thamani kubwa kuliko 8!
Je, unapima pH kwenye aquarium yako, au unayo? Hivyo"nzuri"?
V. Kovalev, E. Kovaleva.
* Hapa tumerahisisha hali kwa kiasi fulani. Yote hapo juu ni kweli ikiwa pH ya maji ya aquarium ni 8.3 au chini. Ikiwa kiashiria hiki ni cha juu kuliko 8.3, basi maji yanaweza kuwa na hydrocarbonates tu, lakini pia carbonates na hata hidroksidi za metali za alkali. Katika kesi hii, wakati wa kuongeza asidi kwa maji, athari zifuatazo zitatokea kwa mlolongo:
OH -
+H +
->H2O
CO3 2
-
+H+ ->HCO 3 -
HCO3 -
+H+

KAZI YA MAABARA Na. 6
Ugumu wa maji.
Kusudi la kazi: Kuamua ugumu wa jumla wa maji kwa kutumia njia ya complexometry; Kuamua carbonate, ugumu wa muda na wa kudumu kwa kutumia njia ya neutralization.
Ugumu wa maji ni kwa sababu ya uwepo wa kalsiamu mumunyifu na chumvi za magnesiamu ndani yake. Ugumu ni idadi ya meq ya Ca 2+ na Mg 2+ ioni iliyo katika lita 1 ya maji. 1 mEq (Kirusi shahada ya ugumu) inalingana na 40.08/2=20.04 mg/l Ca 2+ au 24.3/2=12.15 mg/l Mg 2+.
Kuna jumla, carbonate, ugumu wa muda na wa kudumu na usio wa carbonate.
Ugumu wa jumla inaitwa mkusanyiko wa jumla wa Ca 2+, Mg 2+ ions au kalsiamu na chumvi za magnesiamu.
Ugumu wa muda inaitwa sehemu ya ugumu wa jumla unaoondolewa na maji ya moto kwenye shinikizo la anga. Inasababishwa na uwepo wa bicarbonates za potasiamu na magnesiamu katika maji, ambayo hutengana wakati wa kuchemshwa:
Ca(HCO 3) 2 = CaС0 3 + CO 2 + H 2 O
Mg(HCO 3) 2 = Mg(OH) 2 + 2CO 2
Ugumu wa mara kwa mara ni sehemu ya ugumu wa jumla iliyobaki baada ya kuchemsha maji kwa shinikizo la anga. Inasababishwa na kuwepo kwa chumvi za kalsiamu na magnesiamu ya sulfuriki, hidrokloriki, nitriki, fosforasi na asidi ya silicic, ambayo hubakia katika suluhisho wakati maji yanapochemshwa.
Ugumu wa kaboni inaitwa sehemu ya ugumu wa jumla sawa na mkusanyiko wa carbonates na bicarbonates ya kalsiamu na magnesiamu.
Ugumu usio na kaboni inayoitwa sehemu ya ugumu wa jumla, ni sawa na tofauti kati ya ugumu wa jumla na carbonate.
Kulingana na ugumu, maji yamegawanywa katika: laini sana (0-1.5 mg-eq/l ya chumvi), laini (1.5-3), ngumu ya kati (6-10) na ngumu sana (zaidi ya 10).
Kulingana na GOST 1974-82, ugumu wa maji unaoruhusiwa kwa maji ya kunywa ya ndani haipaswi kuwa zaidi ya 7 mg-eq/l. Chumvi ambayo husababisha ugumu wa maji sio hatari kwa viumbe hai, lakini uwepo wao katika maji kwa kiasi kikubwa haifai, kwani maji huwa haifai kwa mahitaji ya nyumbani.
Mchakato unaosababisha kupungua kwa ugumu wa maji huitwa softening. Kulainishwa kunakuja kupunguza mkusanyiko wa chumvi za kalsiamu na magnesiamu. Njia zilizopo za kupunguza maji zinaweza kugawanywa katika vikundi vitatu: mbinu za reagent: soda-chokaa, alkali, chumvi za bariamu, phosphates; njia ya kubadilishana ion kutumia kubadilishana ion; njia ya joto.
Ugumu umedhamiriwa na njia ya volumetric - complexometric na neutralization.
Uamuzi wa ugumu wa jumla na wa muda wa maji kwa complexometrymbinu.
Hii ndiyo njia sahihi zaidi na iliyoenea zaidi ya kuamua ugumu kamili, kwa kuzingatia uundaji wa ioni za Ca 2+ na Mg 2+ za misombo yenye nguvu ya intracomplex na chumvi ya disodiamu ya asidi ya ethylenediaminetetraacetic Na 2 H 2 Edta au Trilon B:
Wakati wa kutengeneza maji na Trilon B, ioni za kalsiamu na magnesiamu hufunga, na ioni za hidrojeni huingia kwenye suluhisho, ambayo husababisha kuongezeka kwa asidi ya maji. Mkusanyiko wa ioni za hidrojeni juu ya maadili fulani inaweza kusababisha uharibifu wa tata iliyoundwa, kwa hivyo titration hufanywa kwa pH = 8-10. Thamani hii ya pH hupatikana kwa kutumia suluhisho la buffer ya amonia. Hatua ya usawa imedhamiriwa kwa kutumia viashiria vya chuma H 2 Ind: murexide. asidi ya chromojeni nyeusi na wengine, ambayo huunda tata zisizo imara na ioni za kalsiamu na magnesiamu kuliko misombo ya intracomplex ya Trilon B, ambayo huharibiwa wakati wa mchakato wa titration. Kwa hivyo, katika hatua ya usawa, rangi nyekundu-nyekundu ya suluhisho inabadilika kuwa bluu, kwa sababu ya rangi ya kiashiria cha anion Ind:
H 2 Ind = 2H + + Ind 2- Bluu nyekundu nyekundu
Ca 2+ + Ind 2- = Ca Ind
Cherry nyekundu (pH=8-10)
CaInd + Na 2 H 2 Edta = CaNa 2 Edta + 2H + + Ind 2-
Bluu isiyo na rangi
Jaribio la 1. Uamuzi wa ugumu wa jumla
Maendeleo ya uamuzi. Kutumia pipette, chukua 100 ml ya maji ya mtihani kwenye chupa ya conical 250 ml, ongeza 5 ml ya mchanganyiko wa buffer ya amonia na kuongeza nafaka chache za kiashiria kwenye ncha ya spatula. Thibitisha myeyusho wa rangi kwa kutumia suluhu ya kufanya kazi ya Trilon B hadi rangi nyekundu ya cherry ibadilike kuwa samawati. Makini! Rangi ya suluhisho kutoka kwa ziada ya Trilon B inabakia bila kubadilika, kwa hivyo, mwishoni mwa titration, suluhisho la kufanya kazi la Trilon B linapaswa kuongezwa kwa njia ya kushuka. Rekodi matokeo ya titration.
Hesabu. Kuhesabu jumla ya ugumu wa maji kwa kutumia fomula (1), kwa kutumia sheria ya usawa kwa suluhu:
Сн(tr.B) · V(tr.B)
Zhob = 1000, (1)
ambapo Zhob ni jumla ya ugumu wa maji, mEq/l; Сн (tr.B.) - kawaida ya Trilon B, mol / l; V (tr.B) - kiasi cha Trilon B kutumika kwa titration, ml; V (H 2 O) - kiasi cha sampuli ya maji, ml.
Jaribio la 2. Uamuzi wa rigidity ya muda na ya kudumu.
Maendeleo ya uamuzi. Kutumia pipette, pipet 100 ml ya maji ili kujaribiwa kwenye chupa ya conical 250 ml. Weka alama ya kiwango cha maji kwenye chupa na penseli kwenye glasi. Funga chupa na funeli na chemsha kwa saa 1. Wakati wa kuchemsha, maji hutengeneza. Maji kwenye chupa yanapovukiza, ongeza kwa uangalifu maji yaliyosafishwa kwa alama. Baada ya baridi, chuja maji ya kuchemsha kupitia chujio kavu kwenye chupa safi, kavu, suuza chujio mara 2-3 kwa kiasi kidogo cha maji yaliyotumiwa (changanya maji ya suuza na sampuli iliyochujwa). Uamuzi zaidi wa ugumu wa mara kwa mara (Zhpost) na mahesabu hufanywa kama katika majaribio 1.1.
Uhesabuji wa rigidity ya muda. Ugumu wa muda unatambuliwa na tofauti kati ya ugumu wa jumla na wa kudumu.
Zhvr = Zhob. - Zhpost.
Uamuzi wa ugumu wa carbonate kwa njia ya neutralization.
Njia hiyo inategemea mmenyuko wa neutralization - mwingiliano kati ya asidi na alkali. Hatua ya usawa imedhamiriwa kwa kutumia viashiria vya asidi-msingi.
Jaribio la 3. Uamuzi wa ugumu wa carbonate
Njia hiyo inategemea kufungwa kwa HCO 3 - na CO 3 2- ions na asidi mbele ya machungwa ya methyl. Wakati wa titration, athari zifuatazo hutokea:
CO 3 2- + HCO 3 -; HCO 3 - + H + = CO 2 + H 2 O
Maendeleo ya uamuzi. Kwa kutumia pipette, pima 100 ml ya maji ya mtihani kwenye chupa ya conical 250 ml na kuongeza matone 2 ya machungwa ya methyl. Thibitisha sampuli kwa myeyusho wa 0.1 N wa asidi hidrokloriki hadi rangi ya manjano ibadilike na kuwa chungwa. Rekodi matokeo ya titration.
Hesabu. Kuhesabu ugumu wa kaboni ya maji kwa kutumia fomula (2), kwa kutumia sheria ya usawa kwa suluhu:
CH(HCl) V(HC1)
Zhk = 1000 , (2)
ambapo FA ni ugumu wa carbonate, mg-eq/l; CH (HC1) - kawaida ya ufumbuzi wa kazi ya asidi hidrokloric, ml; V (HC1) - kiasi cha asidi hidrokloric kutumika kwa titration, ml; V (H 2 O) - kiasi cha sampuli ya maji, ml.
Hitimisho:
Maswali na kazi.
1. Ni nini kinachoitwa rigidity? Taja vitengo vya kipimo kwa ugumu. Orodhesha madarasa ya ugumu na aina za ugumu.
2. Je, ugumu wa maji unahesabiwaje? Eleza njia hizi na uandike milinganyo ya majibu.
3. Eleza njia za kulainisha maji. Andika milinganyo ya majibu.
4. Resini za kubadilishana ion ni nini: kubadilishana kwa mawasiliano, kubadilishana anion? Toa mifano. Toa dhana na hesabu ya uwezo wa kubadilishana. Uasi wa kubadilishana ioni ni nini? Je, njia ya kubadilisha ioni ina faida gani zaidi ya mbinu za vitendanishi?
5. Ujauzito ni nini? Upeo wa maombi. Faida na hasara za njia.
7. Ni kiasi gani cha 3% cha ufumbuzi wa HCI kitakachohitajika ili kubadilisha ugumu wa carbonate (8 mEq/l) ya 4 m 3 ya maji yanayotumiwa kwenye kibadilisha joto kuwa yasiyo ya kaboni?
8. Ni molekuli gani ya phosphate ya sodiamu lazima iongezwe kwa lita 500 za maji ili kuondokana na ugumu wake wa carbonate sawa na 5 mt-eq / l.
9. Uchambuzi wa maji uliopatikana: ugumu usio na kaboni ni 3.0 mEq/l; ugumu wa carbonate - 4.5 mEq / l; ugumu wa magnesiamu 2.4 mEq / l; bure CO 2 - 8 mEq/l. Kuhesabu kipimo cha chokaa (kwa suala la CaO) na kipimo cha soda isiyo na maji.
10. Amua kiasi cha ioni za kalsiamu zinazofyonzwa na lita I ya kibadilisha sauti ikiwa uwezo wake wa kufanya kazi ni 730 g-eq/m 3.












